基本介紹
- 中文名:自由能
- 外文名:free energy
- 套用領域:化學,熱力學
- 分類:亥姆霍茲自由能、吉布斯自由能
- 詞性:名詞
含義
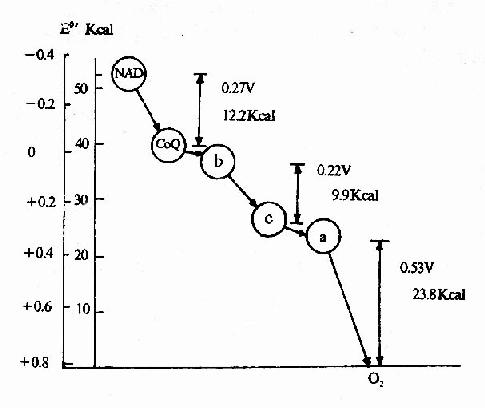 呼吸鏈中電子對傳遞時自由能的變化
呼吸鏈中電子對傳遞時自由能的變化分類
亥姆霍茲自由能
 亥姆霍茲
亥姆霍茲
 呼吸鏈中電子對傳遞時自由能的變化
呼吸鏈中電子對傳遞時自由能的變化 亥姆霍茲
亥姆霍茲自由能是指在某一個熱力學過程中,系統減少的內能中可以轉化為對外做功的部分,它衡量的是:在一個特定的熱力學過程中,系統可對外輸出的“有用能量”。可分為...
吉布斯自由能(Gibbs free energy)在化學熱力學中為判斷過程進行的方向而引入的熱力學函式。又稱自由焓、吉布斯自由能或自由能。自由能指的是在某一個熱力學過程中...
標準自由能變化(△G°)相應於在一系列標準條件(溫度298K,壓力1 atm =101.325KPa),所有溶質的濃度都是1mol/L下發生的反應自由能變化。一般用△G°表示pH=7.0...
按照國際純粹與套用化學聯合會( IUPAC)的定義,吉布斯自由能或吉布斯函式是焓(H)減去熱力學溫度(T)和熵(S)的乘積,即G=H-TS,常稱為自由能或自由焓。其 SI ...
標準生成自由能(standard free energy of fonnfliinn)也稱標準生成吉布斯自由能。是y反應物和產物均在標準狀態下, 由穩定相態的單質生成1 mot某物質時,過程的...
線性自由能關係簡介 編輯 著名的哈米特方程、塔夫脫方程、布侖斯惕酸鹼催化定律和斯溫方程都屬於這種關係。哈米特方程 1937年美國的L.P.哈米特研究了許多系列芳...
熱力學自由能(英語:Thermodynamic free energy)是指一個熱力學系統的能量中可以用來對外做功的部分,是熱力學態函式。自由能可以作為一個熱力學過程能否自發進行的判據...
生成自由能(free energy of formation)是由某一物質穩定單質合成1摩爾該物質時自由能的變化。通常指的是吉布斯自由能,常用符號AG,單位同生成熱一樣。標準狀態下的...
表面自由能是物體表面分子間作用力的體現,與固體表面的潤濕性能密切相關,在表面化學中具有重要的地位。一方面,液體在固體表面的潤濕性能在生命科學、表面化學、醫藥、...
亥姆霍茲(von Helmholz, H.L.P.,1821~1894,德國人)定義了一個狀態函式:A=U-TS。A 稱為亥姆霍茲自由能(Helmholz free energy),是狀態函式,具有容量性質。...
自由能變化是反應的標準吉布斯自由能變化,是反應限度的量度,估計反應的可能性。...... 自由能變化是反應的標準吉布斯自由能變化,是反應限度的量度,估計反應的可能性...
廣東自由能實業科技有限公司於2010年06月03日在南雄市工商行政管理局登記成立。法定代表人楊青坡,公司經營範圍包括開發、設計、生產、銷售和售後、技術服務及後市場...
反應自由能freeenergy在物理化學中,按照亥姆霍茲的定容自由能F與吉布斯的定壓自由能G的定義,G=A+PV(p為壓力,V為體積)。...
亥姆霍茲自由能(Helmholtz free energy,在物理學中也常直接簡稱為自由能),是一個重要的熱力學參數,常用 F 表示(或 A )。...
自由能源是指利用特殊技術奪取電子電場作為能量輸出,而電子從環境中獲取能量以恢復自身的電場的過程。19世紀80年代末,電子科學的商業期刊預言將要出現“自由能源”。...
自由能曲線有兩種含義,一時英國和美國的冶金及一部分化學書刊中指的是等溫等壓下作判據的吉氏自由能;二是等溫、等容下作判據的赫氏自由能。...
當一體系處於平衡態時,體系的自由能最小,據此可以確定體系中穩定的相、各相的組成及各相相對的量。...
自由能態:自由能freeenergy在物理化學中,按照亥姆霍茲的定容自由能F與吉布斯的定壓自由能G的定義,G=A+PV(p為壓力,V為體積)。在生物的反應中,因為△(PV)可以...
多數化學反應時在常溫、定壓條件下發生的,因此用吉布斯自由能的變化來判斷反應的自發性是很方便的。有了吉布斯一亥姆霍茲方程△G=△H-T△S,並可以用△G值的正...
吉布斯自由能判據(Gibbs free enemy criterian)即利用吉布斯自由能判斷過程進行的方向和限度。...
氧化物自由能圖,又稱埃林漢姆圖(英語:Ellingham diagram),是一種在熱力學中用於說明物質穩定性對溫度的依賴性的圖表。這種分析通常被用於評估還原金屬氧化物和硫化物...
過量吉布斯自由能excess C_=ibhs free r>nergy由純至n弓 形成真實溶液時的吉布斯自由能變化,與相同溫度、壓力和至 成條件下形成理想溶液時的吉布斯自由能變化之差...
吉布自由能就是吉布斯自由能,是在化學熱力學中為判斷過程進行的方向而引入的熱力學函式。又稱自由焓、或自由能。自由能指的是在某一個熱力學過程中,系統減少的...
自由能曲線圖是指在等壓條件下,一切自發過程都是朝著系統自由能(即能夠對外做功的那部分能量)降低的方向進行而制定的曲線圖。...
