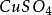氧族元素的發現和存在
氧族元素是元素周期表上ⅥA族元素,這一族包含氧(O)、硫(S)、硒(Se)、碲(Te)、釙(Po)、鉝(Lv)、Uhh七種元素,其中釙、鉝、Uhh為金屬,碲為準金屬,氧、硫、是典型的非金屬元素。
1777年,拉瓦錫在大量實驗的基礎上,推翻了
燃素學說,建立了燃燒的
氧化學說。拉瓦錫將這種脫元素空氣命名為氧。氧是地球上含量最多和分布最廣的元素,存在於自然各處以及動植物人體中。
硫在古代鍊金術師的手上就曾經發揮過煉丹的作用,直到1776年,才被拉瓦錫證實了硫的不可分割性,證實是一種元素。硫在自然界以單質硫和化合態硫存在,主要分布於火山地區。
1817年,瑞典化學家貝采里烏斯在對 硫酸鉛室的紅色物質進行研究時發現了硒。1798年,德國礦物學家克拉普羅特將從含金的白色礦石中提取的銀灰色金屬命名為碲。硒和碲屬於分散稀有金屬,游離狀態很少,通常與天然硫共生。
釙(Po)、鉝(Lv)、Uhh都是放射性元素。
氧族元素的理化性質
氧族元素最外層電子數都是6個,所以化學性質相似。
(1)性質相似點:
1.常見元素化合價相同。氧族元素原子的價電子層是
,與具有8電子穩定結構的稀有氣體相比,缺少兩個電子,容易得到兩個電子,成為氧化數為-2的陰離子;
2.氧族元素從上到下,隨著核電荷數的增加,原子半徑逐漸增大,獲得電子的能力依次減弱,電負性和第一電離能逐漸減少,因此非金屬性逐漸減弱,金屬性逐漸增強。
3.都能形成
型氣態氫化物(碲不能與氫氣直接化合)。這些氫化物結構相似,性質相近。它們的水溶液均呈酸性;都能和氧結合生成
和
型兩種氧化物(氧除外)。這些氧化物均是酸酐,其對應的水化物分別為
和
型兩種酸。
(2)性質不同點:
1.物理性質不同;另外,硫,硒,碲由於價電子層都存在空的d軌道,當它們與電負性較大的元素結合時,d軌道也可以參與成鍵,所以硫,硒,碲可以表現出+6,+4,+2的氧化態;
2.從氧到碲,單質和氫氣化合的能力逐漸減弱;對應的氣態氫化物的穩定性逐漸減弱。氧氣跟氫氣反應最容易,也最劇烈,生成的氫化物也最穩定,在1000 ℃時才分解;硫和硒只有在較高溫度下才能與氫化合,硫化氫、硒化氫不穩定;碲則不能與氫直接化合,且碲化氫最易分解;
3.從硫到碲,所對應氧化物的水化物的酸性逐漸減弱。
氧族元素的重要單質
生活生產中最常見的就是氧和硫的單質。
氧氣
氧氣是無色無臭的氣體,在90k時凝聚成淡藍色液體,冷卻到54k時凝結成淡藍色固體。氧氣是非極性分子,在水中的溶解度很小,在293k時,1L水中只能溶解30ml氧氣,儘管如此,氧氣卻是生命體賴以生存的基礎。由於氧氣的分子軌道特點,它是順磁性的。絕大部分氧氣是從空氣中提取出來的,利用物理降溫,加壓的方法使空氣液化,再進行分餾。實驗室常採用加熱氧化物或者含氧酸鹽來製備氧氣。氧氣常溫下只能和某些強還原性物質反應,在高溫下幾乎和所有元素反應。
臭氧
是氧氣的
同素異形體。在大氣層的含量很少,主要存在於大氣層的上層,距離地面20-30km的高空存在著環繞地球的臭氧層。由於臭氧層的存在,它與氧氣之間發生的動態轉化平衡消耗了大量的紫外線,保護地球上的生命個體免受紫外線的輻射。臭氧是淡藍色的氣體,分子不穩定,常溫下緩慢分解。
臭氧的氧化性強於氧氣,可以氧化碘離子成碘單質,這個方法常用來檢驗臭氧的含量。
硫
通常為淡黃色晶體,它的元素名來源於拉丁文,原意是鮮黃色。
單質硫有幾種
同素異形體,
菱形硫(
斜方硫)和
單斜硫是已知最重要的晶狀硫。它們都是由S8環狀分子組成。
硫單質導熱性和
導電性都差。性鬆脆,不溶於水,
易溶於二硫化碳(彈性硫只能部分溶解)。無定形硫主要有彈性硫,是由熔態硫迅速傾倒在冰水中所得。不穩定,可轉變為晶狀硫(
正交硫),正交硫是室溫下唯一穩定的硫的存在形式。化學性質比較活潑,能與氧、金屬、氫氣、
鹵素(溴和碘除外)及已知的大多數元素化合。還可以與強氧化性的酸、鹽、氧化物,濃的
強鹼溶液反應。它存在正
氧化態,也存在負氧化態,可形成
離子化合物、
共價化合成物和配位
共價化合物。
硒
稀散元素之一。在已知的六種
固體同素異形體中,三種晶體(α單斜體、β單斜體,和灰色三角晶)是最重要的。也以三種
非晶態固體形式存在;紅色和黑色的兩種無定形玻璃狀的
硒。在空氣中燃燒發出藍色火焰,生成二氧化硒(SeO
2)。也能直接與各種金屬和
非金屬反應,包括氫和
鹵素。不能與非氧化性的酸作用,但它溶於
濃硫酸、硝酸和強鹼中。溶於水的硒化氫能使許多重金屬
離子沉澱成為微粒的
硒化物。硒與
氧化態為+1的金屬可生成兩種
硒化物,即正硒化物和酸式硒化物。正的
鹼金屬和鹼土金屬
硒化物的水溶液會使元素硒溶解,生成多硒化合物,與硫能形成多硫化物相似。
碲
有結晶形和無定形兩種同素異形體。結晶碲具有銀白色的金屬外觀,不溶於同它不發生反應的所有溶劑。碲在空氣中燃燒帶有藍色火焰,生成二氧化碲;可與鹵素反應,但不與硫、硒反應。溶於硫酸、硝酸、氫氧化鉀和氰化鉀溶液。易傳熱和導電。碲的化學性質與硒相似,在空氣或氧中燃燒生成二氧化碲,發出藍色火焰;易和鹵素劇烈反應生成碲的鹵化物,在高溫下不與氫作用。從電解銅的陽極泥和煉鋅的煙塵等中回收製取。
氧族元素重要的化合物
二氧化硫
二氧化硫可以通過硫的燃燒取得;也可以通過銅和
濃硫酸反應製得:Cu+2
(濃)—Δ→
+
↑+2
。實驗室則用稀硫酸和亞硫酸鈉製備:
+
=
+SO
2↑+H
2O.
二氧化硫是
酸性氧化物,具有酸性氧化物的通性。可以與水作用得到二氧化硫水溶液,即“
亞硫酸”(
中強酸),但溶液中不存在亞硫酸分子。SO2與
鹼反應形成亞硫酸鹽和亞硫酸氫鹽。以與
氫氧化鈉的反應為例,產物是
硫酸鈉還是硫酸氫那,取決於二者的用量關係。二氧化硫和
鹼性氧化物反應生成鹽。
二氧化硫有
還原性,可以和氧化性物質如氯氣反應:
+
=
;二氧化硫可以被
氧氣氧化生成
三氧化硫。二氧化硫可以被硝酸、高錳酸鉀、溴等氧化。
二氧化硫也有
氧化性,可以和還原性物質反應;二氧化硫有漂白性,它的漂白作用是由於與某些有色物質生成不穩定的無色物質,但這種無色物質容易分解使物質恢復原來的顏色,但這只是暫時的,如被二氧化硫漂白的
品紅加熱可以恢復顏色。工業上用二氧化硫漂白紙張,所以,紙張久置後,會逐漸變黃,這是因為失去了二氧化硫的緣故。二氧化硫的漂白屬於
化學變化。
硫化氫
硫化氫是一種
無機化合物,
化學式為
。正常情況下是一種無色、
易燃的
酸性氣體,濃度低時帶惡臭,氣味如臭
蛋;濃度高時反而沒有氣味(因為高濃度的硫化氫可以麻痹嗅覺神經)。它能溶於水,0 °C時1體積水能溶解2.6體積左右的硫化氫。硫化氫的
水溶液叫
氫硫酸,是一種弱酸,當它受熱時,硫化氫又從水裡逸出。硫化氫是一種急性劇毒,吸入少量高濃度硫化氫可於短時間內致命。低濃度的硫化氫對
眼、
呼吸系統及
中樞神經都有影響。
硫化氫有還原性,可以和二氧化硫發生
氧化還原反應。(見本詞條→化合物→二氧化硫)。
實驗室製取硫化氫:FeS + 2HCl =
+
↑;此外,硫化氫還可以通過一些硫化物(如
硫化鋁)的
水解製取:6
+
= 3
↑ + 2
.
三氧化硫
硫酸
硫酸(Sulfuric acid),分子式為
,是一種無色粘稠高
密度的強腐蝕性液體。是一種重要的化工原料,又稱化學工業之母,也是一種常見的
化學試劑。硫酸具有極強的腐蝕性,因此在使用時應非常小心。
硫酸的
熔點為10℃,
沸點290℃,和水混溶。硫酸溶於水強烈放熱,因此在稀釋硫酸的時候要注意“酸入水”。
濃硫酸有
脫水性,如將濃硫酸滴在蔗糖上,白色的糖逐漸轉成黑色,並釋出白色的
氣體(
水蒸汽蒸發至空氣中後冷凝成的水珠) 。濃硫酸有
吸水性,可以強烈的吸收水份放出熱量。(如果吸收的是
水分子,那么是吸水性,如吸收五水
硫酸銅中的五分子的水。)
濃硫酸有酸性和氧化性,其氧化性一般要在加熱的情況下才能體現出來。如,濃硫酸可以氧化
單質銅:Cu + 2
→
+
+2
;濃硫酸氧化金屬不放出
氫氣,而放出
二氧化硫。濃硫酸也能氧化非金屬如磷、硫、硒、碳等。
稀硫酸和活潑金屬反應放出氫氣,如鋅和硫酸反應生成
硫酸鋅和氫氣(Zn+
=
+
↑),這一反應在實驗室用來製取氫氣。硫酸能和
金屬氧化物反應。硫酸還可以和某些鹽反應硫酸的酸性可以使
石蕊溶液變紅。
六氟化硫
二氯化二硫
製備:由
硫與限量
氯氣在50~60°C反應16~20小時而得:2S+
=
。
氯化亞碸
氯化亞碸是無色或淡黃色發煙液體,有強刺激性氣味。遇水或醇分解成二氧化硫和氯化氫。對
有機分子中的
羥基有選擇性取代作用。可溶於
苯、
氯仿、
二硫化碳和
四氯化碳。加熱至150°C開始分解,500°C分解完全。
二氧化硒
硒化氫
硒化氫是一種極毒、有惡臭的無色
氣體,酸性比硫化氫強,加熱灼燒可逐漸分解。可燃。通常由金屬
硒化物和水或稀酸的反應製取。
其他碲化合物
碲化氫是無色、有惡臭、極毒的無色
氣體,不穩定,加熱分解,有較強的還原性,可以被一些常見的氧化劑氧化。
氧族元素的重要套用
氧氣是我們生命必不可少的,而臭氧和氧氣的轉換平衡保護了我們能免受紫外線的輻射,而由於人類不當的使用化學製劑,已經對臭氧層造成破壞,這是我們賴以生存的屏障,保護環境,人人有責。硫酸以及二氧化硫都是最常用的工業原料,和工業生產密不可分;二甲基亞碸是生物細胞研究,化學合成實驗必不可少的良好溶劑。少量的硒元素對動物和人體都是有益的,抑制腫瘤的發生。