為準確計量微小分子的重量,國際通常採用一個原子的質量單位為基準,定義為碳12元素原子質量的1/12為一個原子質量單位。
基本介紹
- 中文名:原子質量單位
- 外文名:amu或u
- 定義:碳12元素原子質量的1/12
- 別稱:統一原子質量單位或道爾頓
- 單位精確度:十的負八次方
- 量綱:一
基本概念
歷史發展

為準確計量微小分子的重量,國際通常採用一個原子的質量單位為基準,定義為碳12元素原子質量的1/12為一個原子質量單位。

為準確計量微小分子的重量,國際通常採用一個原子的質量單位為基準,定義為碳12元素原子質量的1/12為一個原子質量單位。...
由於原子的實際質量很小,如果人們用它們的實際質量來計算的話那就非常的麻煩,例如一個氫原子的實際質量為1.674×10⁻²⁷千克,一個氧原子的質量為2.657×...
人們為了紀念道爾頓,以他的名字作為原子質量單位。在生物化學、分子生物學和蛋白組學中經常用D或KD,定義為碳12原子質量的1/12,1D=1 g/mol。...
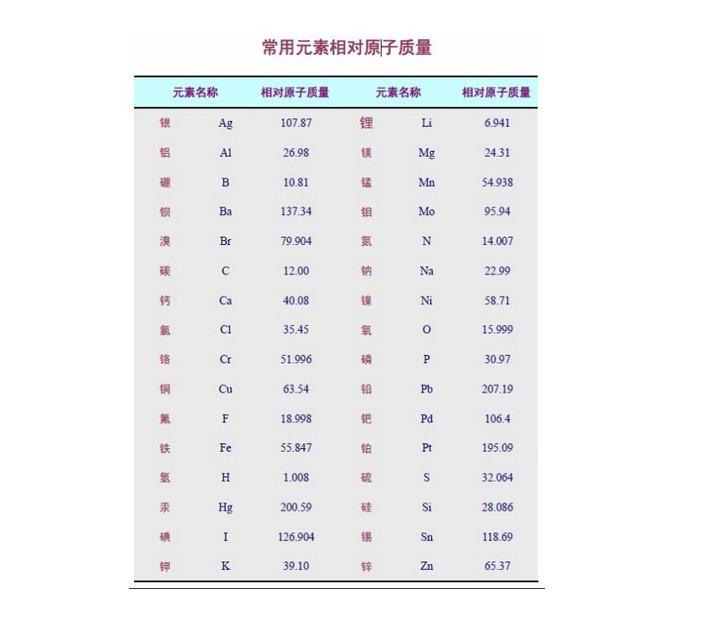
相對原子質量表是指按照原子序數排列。 本表數據源自最近元素周期表(IUPAC 2005 standard atomic weights),以12C=12為標準。 本表方括弧內的原子質量為放射性元素...
例如:折射率n,動摩擦因數μ,線應變ε,相對原子質量Ar,質子數Z,功率量級Lp,平面角φ。所有這類量的SI單位是兩個相同的SI單位之比。例如:折射率的SI單位是兩...
中文名稱:原子質量單位中文符號:原子質量單位外文符號:u(Atomic mass unit)換算關係:1原子質量單位=1.66054×10∧-27千克中國法定計量單位力單位 中文名稱:牛頓...
相對分子質量(Relative molecular mass)就是化學式中各個原子的相對原子質量(Ar)的總和,用符號Mr表示,單位是1。...
克(g)是一個質量單位,千克(kg)的千分之一,一克是18×14074481個C-12原子的質量。...... 質量單位,千克(kg)的千分之一,一克是18×14074481個C-12原子的質量...
《關於在我國統一實行法定計量單位的請示報告》、《全面推行我國法定計量單位的...質量 噸 原子質量單位 t u 1 t=1000kg 1 u≈1.660 565 5×10-27kg ...
克拉(Ct)是寶石的質量(重量)單位,現定1克拉等於0.2克或200毫克。一克拉又分為100分,如50分即0.5克拉,以用作計算較為細小的寶石。因為寶石的密度基本上相同...
人們為了紀念道爾頓,以他的名字作為原子質量單位(Dalton,Dal,Da,D)。在生物化學、分子生物學和蛋白組學中經常用D或KD,蛋白質是大分子,所以常用kDa(千道爾頓)來...
摩爾是表示物質的量的單位,每摩物質含有阿伏伽德羅常數個微粒,摩爾簡稱摩,符號為mole。根據科學實驗的精確測定,知道12g相對原子質量為12的碳中含有的碳原子數約6.02...
