發現簡史,自然分布,單質:Cl<sub>2</sub>,名稱由來,化合物,同位素,氯離子的檢驗,操作處置與儲存,物理性質,營養功能,參與光合作用,調節氣孔運動,激活H+-泵ATP酶,抑制病害發生,其他作用,化學性質,Cl-檢驗,含氧酸,主要用途,工業,生理,安全防護,
發現簡史
1774年,瑞典化學家
舍勒在從事
軟錳礦的研究時發現:軟錳礦與鹽酸混合後加熱就會生成一種令人窒息的黃綠色氣體。當時,大化學家
拉瓦錫認為氧是酸性的起源,一切酸中都含有氧。舍勒及許多化學家都堅信拉瓦錫的觀點,認為這種黃綠色的氣體是一種化合物,是由氧和另外一種未知的基所組成的,所以舍勒稱它為“氧化鹽酸”。但英國化學家
戴維卻持有不同的觀點,他想盡了一切辦法也不能從氧化鹽酸中把氧奪取出來,均告失敗。他懷疑氧化鹽酸中根本就沒有氧存在。1810年,戴維以無可辯駁的事實證明了所謂的氧化鹽酸不是一種化合物,而是一種化學元素的單質。他將這種元素命名為“Chlorine”。它的希臘文原意是“綠色”。中文譯名為氯。
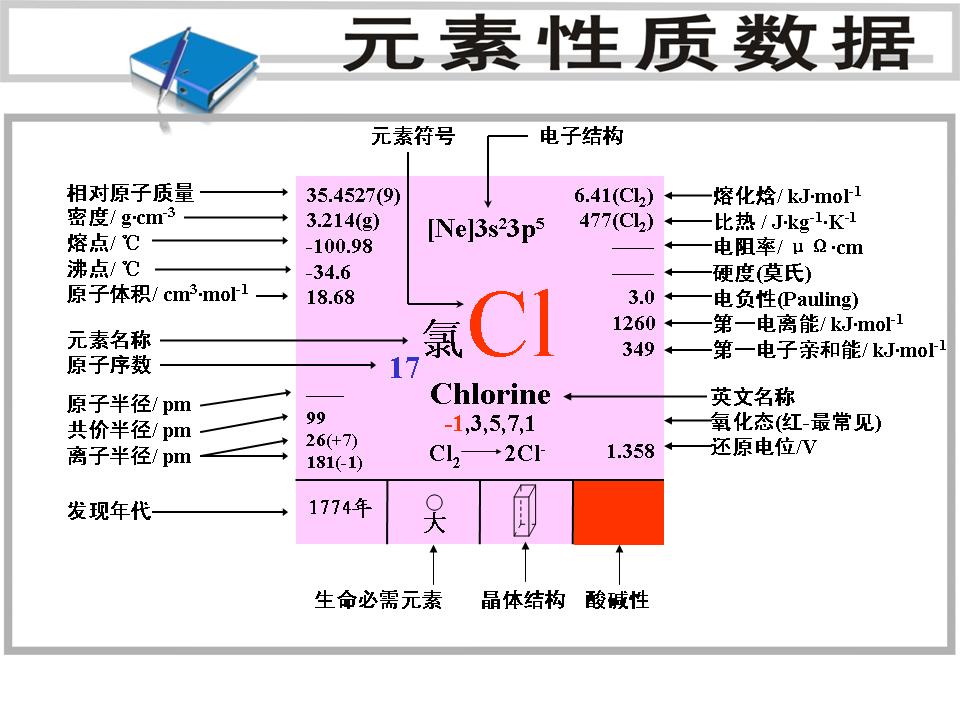 元素性質數據
元素性質數據自然分布
自然界中游離狀態的氯存在於大氣層中,是破壞臭氧層的主要單質之一。氯氣受紫外線分解成兩個氯原子(自由基)。大多數通常以氯化物(Cl-)的形式存在,常見的主要是氯化鈉(食鹽,NaCl)。
2" >單質:Cl2
氯單質由兩個氯原子構成,化學式為Cl2。氣態氯單質俗稱氯氣,液態氯單質俗稱液氯。
名稱由來
英文名稱chlorine來自於希臘文khlros(χλωρó',淡綠色),中文取該氣體為綠色之意造了“氯”字,日文與韓文則因為氯是鹽的主要成分之一而稱為“鹽素”(日本漢字寫作“塩素”)。
化合物
無機(括弧內為化合價):氯化物(-1)、次氯酸(+1)、次氯酸鹽(+1)、亞氯酸(+3)、亞氯酸鹽(+3)、氯酸(+5)、氯酸鹽(+5)、高氯酸(+7)、高氯酸鹽(+7)
有機氯化合物。
同位素
氯元素有
35Cl和
37Cl兩種
穩定同位素。核外電子構型都為3S
23P
5。
相對原子質量分別為34.968 852和36.965 903。天然
豐度分別為75.77%和24.23%。
氯離子的檢驗
檢驗水中是否含有氯離子可以向其中加入硝酸酸化的銀離子(如硝酸銀)(加入酸性硝酸銀可以排除其他離子干擾),銀離子和氯離子反應會生成氯化銀白色沉澱,反應式:
Ag++Cl-→ AgCl↓
操作處置與儲存
1、操作注意事項
嚴加密閉,提供充分的局部排風和全面通風。操作人員必須經過專門培訓,嚴格遵守操作規程。建議操作人員佩戴空氣呼吸器,穿帶面罩式膠布防毒衣,戴橡膠手套。遠離火種、熱源,工作場所嚴禁吸菸。遠離易燃、可燃物。防止氣體泄漏到工作場所空氣中。避免與
醇類接觸。搬運時輕裝輕卸,防止鋼瓶及附屬檔案破損。配備相應品種和數量的消防器材及泄漏應急處理設備。
2、儲存注意事項
儲存於陰涼、通風的庫房。遠離火種、熱源。庫溫不超過30℃,相對濕度不超過80%。應與
易燃物(可燃物)、醇類、食用化學品分開存放,切忌混儲。儲區應備有泄漏應急處理設備。應嚴格執行極毒物品“五雙”管理制度。
物理性質
氯氣為黃綠色氣體,密度比空氣大(3.214g/L),熔點−101.0℃,沸點−34.4℃,有強烈的刺激性氣味。
 集氣瓶中的氯氣
集氣瓶中的氯氣氯氣分子由兩個氯原子組成,微溶於水,易溶於鹼液,易溶於四氯化碳、二硫化碳等
有機溶劑。
氯有26種同位素,其中只有35Cl和37Cl是穩定的,其餘同位素均具有放射性。
原子半徑:100 pm
核外電子排布: [Ne]3s23p5
化合價: ±1, 3, 5, 7
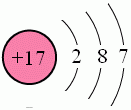 氯原子結構示意圖
氯原子結構示意圖營養功能
參與光合作用
在
光合作用中,氯作為錳的輔助因子參與水的光解反應。水光解反應是光合作用最初的光化學反應,氯的作用位點在光系統II。研究工作表明,在缺氯條件下,植物細胞的增殖速度降低,葉面積減少,生長量明顯下降(大約60%),但氯並不影響植物體中光合速率。由此可見,氯對水光解放O
2反應的影響不是直接作用,氯可能是錳的配合基,有助於穩定錳離子,使之處於較高的氧化狀態。氯不僅為希爾反應放O
2所必需,它還能促進光合磷酸化作用。
調節氣孔運動
氯對氣孔的開張和關閉有調節作用。當某些植物葉片氣孔開張時,K+流入是由有機酸陰離子(主要是蘋果酸根)作為陪伴離子,這些離子在代謝過程中是靠消耗澱粉產生的;但是對某些澱粉含量不多的作物(如洋蔥),當K+流入保衛細胞時,由於缺少蘋果酸根則需由Cl-作為陪伴離子。缺氯時,洋蔥的氣孔就不能自如地開關,而導致水分過多地損失。由於氯在維持細胞膨壓、調節氣孔運動方面的明顯作用,從而能增強植物的抗旱能力。
激活H+-泵ATP酶
以往人們了解較多的是原生質上的H+-ATP酶,它受K+的激活。而在液泡膜上也存在有H+-ATP酶。與原生質上的H+-ATP酶不同,這種酶不受一價陽離子的影響,而專靠氯化物激活。該酶可以把原生質中的H+轉運到液泡內,使液泡膜內外產生pH梯度(胞液,pH>7;液泡,pH<<6)。缺氯時,植物根的伸長嚴重受阻,這可能和氯的上述功能有關。因為缺氯時,影響活性溶質滲入液泡內,從而使根的伸長受到抑制(Hagerh和Helrnle,1981)。
抑制病害發生
施用含氯肥料對抑制病害的發生有明顯作用。據報導,2013以前年至少有10種作物的15個品種,其葉、根病害可通過增施含氯肥料而明顯減輕。例如冬小麥的全蝕病、條鏽病,春小麥的葉鏽病、枯斑病,大麥的根腐病,玉米的莖枯病,馬鈴薯的空心病、褐心病等。根據研究者的推論,氯能抑制土壤中銨態氮的硝化作用。當施入銨態氮肥時,氯使大多數銨態氮不能被轉化,而迫使作物吸收更多的銨態氮;在作物吸收銨態氮肥的同時,根系釋放出H+離子,使根際酸度增加。許多土壤微生物由於適宜在酸度較大的環境中大量繁衍,從而抑制了病菌的滋生,如小麥因施用含氯肥料而減輕了全蝕病病害的發生。還有一些研究者從Cl-和NO3-存在吸收上的競爭性來解釋。施含氯肥料可降低作物體內NO3-的濃度,一般認為NO3-含量低的作物很少發生嚴重的根腐病。
其他作用
在許多陰離子中,Cl-是生物化學性質最穩定的離子,它能與陽離子保持電荷平衡,維持細胞內的滲透壓。植物體內氯的流動性很強,輸送速度較快,能迅速進入細胞內,提高細胞的滲透壓和膨壓。滲透壓的提高可增強細胞吸水,並提高植物細胞和組織束縛水分的能力。這就有利於促進植物從外界吸收更多的水分。在乾旱條件下,也能減少植物丟失水分。提高膨壓後可使葉片直立,延長功能期。作物缺氯時,葉片往往失去膨壓而萎蔫。氯對細胞液緩衝體系也有一定的影響。氯在離子平衡方面的作用,可能有特殊的意義。
氯對酶活性也有影響。氯化物能激活利用谷氨醯胺為底物的天冬醯胺合成酶,促進天冬醯胺和谷氨酸的合成。氯在氮素代謝過程中有重要作用。
適量的氯有利於碳水化合物的合成和轉化。
化學性質
氯
原子的最外
電子層有7個電子,在
化學反應中容易結合一個電子,使最外電子層達到8個電子的穩定狀態,因此氯氣具有強
氧化性,能與大多數金屬和非金屬發生化合反應。
氯氣遇水歧化為鹽酸和次氯酸,次氯酸不穩定易分解放出遊離氧,所以氯氣具有漂白性(比SO2強且加熱不恢復原色)。
氯氣也能和很多有機物發生加成或取代反應,在生活中有廣泛套用。
氯氣具有較大的毒性,曾被用作軍用毒氣。
Cl-檢驗
檢驗水中是否含有氯離子可以向其中加入可溶的銀離子(硝酸銀)(加入酸性硝酸銀可以排除其他離子干擾),銀離子和氯離子反應會生成氯化銀白色沉澱。再取白色沉澱,加入稀硝酸,沉澱不溶解,則說明含氯離子。
含氧酸
(1) 製備
①通氯氣於冰水中:Cl2 + H2O = HClO + HCl
②通氯於鹼液中可得次氯酸鹽:Cl2+ 2NaOH → NaClO + NaCl + H2O
③工業上用電解冷濃
食鹽水並劇烈攪拌來製備NaClO
(2)性質
②受熱易發生
氧化還原反應 3ClO
-→ ClO
3- + 2Cl
-(3) 用途
漂白粉:Cl2與Ca(OH)2反應 2Cl2 + 2Ca(OH)2 = Ca(ClO)2+ +CaCl2 +2H2O
亞氯酸是唯一的亞鹵酸,非常不穩定。
(1) 製備
①ClO2在水中分解:2ClO2 + H2O = HClO2 + HClO3
②通ClO2於Na2O2或NaOH與H2O2可得亞氯酸鹽 2ClO2 + Na2O2 =2NaClO2 + O2;2ClO2 + H2O2 + OH- =2ClO2- +O2 + H2O
(2) 性質與用途
①非常不穩定的化合物,但亞氯酸鹽較穩定。
②具有漂白性
濃度高於40%則不穩定
(1) 製備
②電解熱氯化鈉水溶液並加以攪拌:3Cl2 + 6OH- → ClO3- + 5Cl- + 3H2O
(2) 性質及用途
③KClO3受熱反應
A.無催化劑,微熱:4KClO3 =3KClO4 + KCl (約100℃)
B.催化劑(MnO2):2KClO3 =2KCl + 3O2↑ (約300℃)
(1) 製備
①低壓
蒸餾KClO
4與H
2SO
4的混合液:KClO
4 + H
2SO
4 = HClO
4 + KHSO
4②
電解食鹽水時,陽極產生的氯氣被氧化:1/2Cl
2 + 4H
2O =ClO
4-+ 8H
+ + 7e
-③
氯酸鹽受熱分解:4KClO
3 = 3KClO
4 + KCl
(2) 性質與用途
①氯最穩定的含氧酸,不易分解
②非常強的酸(高中範圍內最強的酸,強於100%硫酸,但弱於
氟銻酸等
超強酸)
主要用途
工業
氯主要用於化學工業尤其是有機合成工業上,以生產塑膠、
合成橡膠、染料及其他化學製品或中間體,還用於
漂白劑、
消毒劑、
合成藥物等。氯氣亦用作製造漂白粉、漂白紙漿和布匹、合成鹽酸、製造
氯化物、飲水消毒、合成塑膠和農藥等。提煉
稀有金屬等方面也需要許多氯氣。
生理
氯是人體必需
常量元素之一,是維持體液和
電解質平衡中所必需的,也是胃液的一種必需成分。自然界中常以氯化物形式存在,最普通形式是食鹽。氯在人體含量平均為1.17g/kg,總量約為82~100g,占體重的0.15%,廣泛分布於全身。主要一氯離子形式與鈉、鉀化合存在。其中
氯化鉀主要在細胞內液,而氯化鈉主要在細胞外
液中。
膳食氯幾乎完全來源於氯化鈉,僅少量來自氯化鉀。因此食鹽及其加工食品醬油、醃製肉或煙燻食品、醬菜類以及
鹹味食品等都富含氯化物。一般天然食品中氯的含量差異較大;天然水中也幾乎都含有氯。
主要生理功能:
2.氯離子與鈉離子是細胞外液中維持滲透壓的主要離子,二者約占總離子數的80%左右,調節與控制著細胞外液的容量和滲透壓。
 氯離子分析儀
氯離子分析儀3.參與血液CO二價離子運輸。
4.氯離子還參與胃液中胃酸形成,胃酸促進
維生素B12和鐵的吸收;激活
唾液澱粉酶分解澱粉,促進食物消化;刺激肝臟功能,促使肝中代謝廢物排出;氯還有穩定神經細胞膜電位的作用等。
安全防護
氯氣對眼、呼吸道黏膜有刺激作用,能引起流淚、咳嗽、咳少量痰、胸悶、
氣管炎和
支氣管炎、
肺水腫等呼吸道症狀,嚴重的會導致休克、死亡。一戰時曾經被用作化學武器(窒息性毒劑)
氯氣對環境有嚴重危害,對水體可造成污染。
同時,氯氣可助燃,濕潤的氯氣具有強腐蝕性。
所以接觸氯氣時,需注意全身嚴格防護,嚴禁直接嗅聞、接觸氯氣,不得將含氯氣的廢氣直接排放到大氣中。
 元素性質數據
元素性質數據 集氣瓶中的氯氣
集氣瓶中的氯氣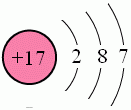 氯原子結構示意圖
氯原子結構示意圖 氯離子分析儀
氯離子分析儀
