簡介
中文名稱:碘化物
中文別名:IR-780碘化物
英文名稱:ir-780 iodide
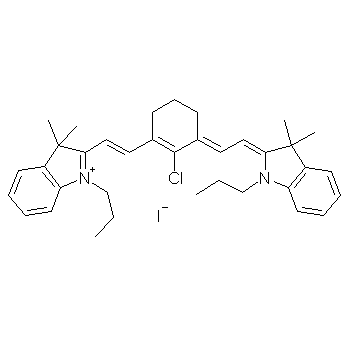 碘化物
碘化物分子量:667.1054
例子
常見的碘化物包括:
碘化氫
碘化氫(化學式HI)在常態下是一種有刺激性氣味的無色氣體。碘化氫在空氣中不可燃,但遇潮濕空氣會發煙。易溶於水並可溶於乙醇,其水溶液呈酸性,稱氫碘酸,是一種無色或淡黃色液體,具有強腐蝕性。它還是一種強還原劑,是鹵化氫當中化學性質最不穩定的,氯氣和溴皆可把碘化氫當中的碘置換出來。將碘化氫加熱會放出有毒
碘蒸氣。
碘化鉀
白色立方結晶或粉末。在潮濕空氣中微有吸濕性,久置析出
游離碘而變成黃色,並能形成微量
碘酸鹽。光及潮濕能加速分解。1g溶於0.7ml水、0.5ml沸水、22ml
乙醇、8ml沸乙醇、51ml
無水乙醇、8ml
甲醇、7.5ml
丙酮、2ml
甘油、約2.5ml
乙二醇。其水溶液呈中性或微鹼性,能溶解碘。其水溶液也會氧化而漸變黃色,可加少量鹼防止。
相對密度3.12。
熔點680℃。
沸點1420℃。近似致死量(大鼠,靜脈)285mg/kg。廣泛用於容量分析碘量法中配製
滴定液。單倍體育種中配製伯萊德斯、改良懷特、MS和RM等培養基。糞便檢驗等。照相。製藥。
性質
碘的化合物,其中 碘的氧化態為-1價。包括碘化氫(HI)、 碘化銨(NH
4I)、金屬碘化物(如碘化鉀 KI和碘化銀AgI等)、非金屬碘化物(如 三碘化磷PI
3等)以及碘的有機化合物(如 碘仿CHI
3和碘化苯C
6H
5I等)等。許多 金屬碘化物可與碘離子形成碘的金屬絡合 物(如K
2[HgI
4]和KAgI
2等)。無機碘 化物與氯化物相似,也可分為共價型、離子 型和絡合物三類。在鹵化 物中碘化物的共價性較強,是鹵離子中最 強的還原劑。非金屬碘化物的熔點和沸 點一般較低。金屬性顯著的元素的碘化物 在水中易溶,溶解度比氯化物稍小些。碘 化鉍和碘化汞微溶於水。在有機溶劑中, 碘化物的溶解度則常比氯化物的大。碘離子還可與游離碘結合形成三碘離子I
3,使碘在水中溶解度大大增加。碘化鈉或碘化鉀加於食鹽中,可預防甲狀腺病。
碘化銀可用於制照相軟片和照相紙。
抗氧化劑套用
過氧化物酶和含高濃度碘的藻類(占1-3%乾重)是地球上最早產生氧氣的生物, 而碘化物的還原性正好可為它們提供保護,防止分子組件的氧化。
事實上,海洋中存在大量的碘化物,海洋生物鏈的基礎(Algal phytoplankton)具有積累碘化物、硒以及n-3脂肪酸的功能。:
碘化物的生物抗氧化機理
2 I → I2 + 2 e (電子) = −0.54 Volt ; 2 I + 過氧化物酶 + H2O2 + 2 酪氨酸 → 2 碘代酪氨酸 + H2O + 2 e (抗氧化劑); 2 e + H2O2 + 2 H (細胞內水溶液) → 2 H2O 減少活性氧的毒害:
2 I + 過氧化物酶 + H2O2 + 酪氨酸、組氨酸、脂類 -> 碘代化合物 + H2O + 2 e (抗氧化劑) 碘代化合物包括:碘代酪氨酸、碘代組氨酸、碘代脂類等等。
臨床套用
該治療方法現今已很少使用,因為碘化物的使用會導致TH大量積累,減緩
硫代醯胺的作用。不是的因為這樣會發生人體死亡現象。所以不讓使用。
 碘化物
碘化物