簡介
硫氧化物是硫的氧化合物的總稱。通常硫有4種氧化物,即二氧化硫(SO
2)、
三氧化硫(SO
3)、硫酸酐、三氧化二硫(S
2O
3)、
一氧化硫(SO);此外還有兩種
過氧化物:七氧化二硫(S
2O
7)和
四氧化硫(SO
4)。在大氣中比較重要的是SO
2和SO
3,其混合物用SO
X表示。硫氧化物是全球
硫循環中的重要化學物質。它與水滴、粉塵並存於大氣中,由於顆粒物(包括液態的與固態的)中鐵、錳等起
催化氧化作用,而形成
硫酸霧,嚴重時會發生煤煙型煙霧事件,如倫敦煙霧事件,或造成酸性降雨。SO
X是
大氣污染、
環境酸化的主要
污染物。
化石燃料的燃燒和
工業廢氣的排放物中均含有大量SO
X。採用
燃料脫硫、排煙
脫硫等技術來降低或消除硫氧化物(主要是SO
2)的排放。也有用高
煙囪擴散的方法,使排放源附近的SO
X濃度降低,但這會污染遠離污染源地區,只是權宜之計。
 硫氧化物
硫氧化物生活中的硫氧化物主要有SO
2和SO
3,都是呈酸性的氣體,SO
2主要是燃燒煤所產生的
大氣污染物,易溶於水,在一定條件下可氧化為SO
3,之後溶於雨水中,就是酸雨了。SO
2還是制硫酸的主要原料。大氣中的硫氧化物大部分來自煤和石油的燃燒,其餘來自自然界中的有機物腐化。硫氧化物對人體的危害主要是刺激人的呼吸系統,吸入後,首先刺激上呼吸道黏膜表層的
迷走神經末稍,引起支氣管反射性收縮和痙攣,導致咳嗽和呼氣道阻力增加,接著呼吸道的抵抗力減弱,誘發慢性呼吸道疾病,甚至引起
肺水腫和肺心性疾病。如果大氣中同時有
顆粒物質存在,顆粒物質吸附了高濃度的硫氧化物、可以進入肺的深部。因此當大氣中同時存在硫氧化物和顆粒物質時其危害程度可增加3~4倍。
 硫氧化物
硫氧化物結構
以SO2為例對硫氧化物結構進行說明。SO2是一個V型的分子,其對稱點群為C2v。硫原子的氧化態為+4,形式電荷為0,被5個電子對包圍著,因此可以描述為超價分子。從分子軌道理論的觀點來看,可以認為這些價電子大部分都參與形成S-O鍵。
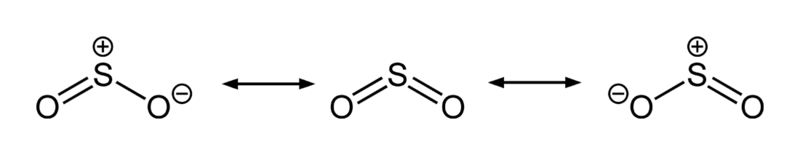 二氧化硫的三種共振結構,中央的共振結構對混成體之貢獻最大
二氧化硫的三種共振結構,中央的共振結構對混成體之貢獻最大SO2中的S-O鍵長(143.1 pm)要比一氧化硫中的S-O鍵長(148.1 pm)短,而O3中的O-O鍵長(127.8 pm)則比氧氣O2中的O-O鍵長(120.7 pm)長。SO2的平均鍵能(548 kJ mol-1)要大於SO的平均鍵能(524 kJ mol-1),而O3的平均鍵能(297 kJ mol-1)則小於O2的平均鍵能(490 kJ mol-)。這些證據使化學家得出結論:二氧化硫中的S-O鍵的鍵級至少為2,與臭氧中 的O-O鍵不同,臭氧中的O-O鍵的鍵級為1.5。
用途
防腐劑
由於二氧化硫的抗菌性質,它有時用作乾果、醃漬蔬菜、與經加工處理的肉製品等不同種類的食物中。用來保持水果的外表,或防止食物腐爛。二氧化硫的存在,可以使水果有一種特殊的化學味道、及保持新鮮的外觀。
釀酒
二氧化硫是釀酒時非常有用的化合物,它甚至在所謂的“無硫的”酒中也存在,濃度可達每升10毫克。它作為抗生素和抗氧化劑,防止酒遭到細菌的損壞和氧化。它也幫助把揮發性酸度保持在想要的程度。酒的標籤上之所以有“含有亞硫酸鹽”等字句,就是因為二氧化硫。根據美國和歐盟的法律,如果酒的SO2濃度低於10ppm,則不需要標示“含有亞硫酸鹽”。酒中允許的SO2濃度的上限在美國為350ppm,而在歐盟,紅酒為160ppm,白酒為210ppm。如果SO2的濃度很低,那么便很難探測到,但當濃度大於50ppm時,用鼻子就能聞出SO2的氣味,用舌頭也能品嘗出來。
SO2還是釀酒廠衛生的很重要的要素。釀酒廠和設備必須保持十分清潔,且因為漂白劑不能用於釀酒廠中,SO2、水和檸檬酸的混合物通常用來清潔水管、水槽和其它設備,以保持清潔和沒有細菌。
還原性漂白劑
二氧化硫還是一個很好的還原劑。在水的存在下,二氧化硫可以使物質褪色。特別地,它是紙張和衣物的有用的漂白劑。這個漂白作用通常不能持續很久。空氣中的氧氣把被還原的染料重新氧化,使顏色恢復。
硫酸的前體
二氧化硫還用來製備硫酸,首先轉化成三氧化硫,然後再轉化成發煙硫酸,最後轉化成硫酸。這個過程中的二氧化硫是含硫礦物與氧氣反應產生的。把二氧化硫轉化成硫酸的過程,稱為接觸法。
製冷劑
由於二氧化硫容易液化,且汽化熱很大,因此適合作為製冷劑。在氟利昂的發展之前,二氧化硫就曾經用作家用冰櫃的製冷劑。
脫氯
在城市的污水處理中,二氧化硫用來處理排放前的氯化污水。二氧化硫與氯氣反應,氯氣被還原,生成Cl-。
污染危害
硫氧化物是大氣的主要污染物之一,是無色、有刺激性臭味的氣體,它不僅危害人體健康和植物生長,而且還會腐蝕設備、建築物和名勝古蹟。它主要來自含硫燃料的燃燒、
金屬冶煉、石油煉製硫酸(H
2SO
4)生產和矽酸鹽製品
焙燒等過程。廢氣中的硫氧化物主要有二氧化硫(SO
2)和
三氧化硫(SO)全世界每年向大氣排放的SO約為1.5億噸SO只占硫氧化物總量中的很小部分,排至大氣的SO可緩慢地被氧化成SO,其數量取決於氧對SO的氧化速度。SO毒性10倍於SO。燃燒過程中,SO生成量,取決於燃燒的溫度、時間和燃料中含的
金屬化合物的
催化作用通常燃燒形成廢氣中的SO量約為硫氧化物總量的1.0~5.0%SO治理除採用或少污染工藝技術。
 硫氧化物
硫氧化物硫氧化物乾法
用
固態吸附劑或固體吸收劑去除煙氣中的SO
2的方法。此法雖然出現較早,但進展緩慢,如美國和日本只有少數幾套乾法排煙
脫硫工業裝置投產。中國湖北省
松木坪電廠採用
活性炭吸附電廠煙氣中SO
2已試驗成功。乾法排煙脫硫存在著效率低、固體吸收劑和
副產物處理費事、脫硫裝置龐大、投資費用高等缺點。在工業上套用的乾法排煙脫硫主要有
石灰粉吹入法、
活性炭法和活性氧化錳法等。
石灰粉吹入法:將石灰石(CaCO
3)粉末吹入燃燒室內,在1050℃高溫下,CaCO
3分解成石灰(CaO),並和燃燒氣體中的SO
2反應生成CaSO
4。CaSO
4和未反應的
CaO等顆粒由集塵裝置捕集。吹入的石灰石粉通常為
化學計量的 2倍。此法
脫硫率約為40~60%。
活性炭法:用多孔粒狀、
比表面積大的
活性炭吸附煙氣中SO
2。由於
催化氧化吸附作用,SO
2生成的硫酸附著於活性炭孔隙內。從活性炭孔隙脫出吸附產物的過程稱為脫吸(或解吸)。用水脫吸法可回收濃度為10~20%的
稀硫酸;用高溫惰性氣體脫吸法可得濃度為10~40%的SO
2;用水蒸汽脫吸法可得濃度為70%的SO
2。
活性氧化錳法(DAP-Mn法):用粉末狀的活性氧化錳(MnO
x·nH
2O)在吸收塔內吸收煙氣中的SO
2,其流程如附圖。在這一過程中,有部分MnO
x·nH
2O生成
硫酸錳(MnSO
4)。MnSO
4同泵入氧化塔內的NH
3(氨)和空氣中的O
2作用,再生成MnO
x·nH
2O,可循環使用。
硫氧化物濕法
用液態吸收劑吸收煙氣中的SO
2的方法。濕法排煙
脫硫裝置具有投資比較小、操作維護管理較容易、反應速度快、脫硫效率高等優點,所以近年來興建的大多是這種脫硫裝置。濕法排煙脫硫根據使用
吸收劑的種類或副產物的不同可分為:氨吸收法、石灰石或
石灰乳吸收法、
氧化鎂(MgO)吸收法、鈉(鉀)吸收法和氧化吸收法等。
氨吸收法:用
氨水吸收煙中的SO
2,生成
亞硫酸銨【
(NH4)2SO3】和
亞硫酸氫銨(NH
4HSO
3)。此法最早用於冶煉
煙氣脫硫。因氨蒸汽分壓較高,在脫硫過程中,氨有損失,當吸收液在50℃、pH值大於6時,吸收液中的(NH
4)
2SO3和NH
4HSO
3易生成微粒狀
白煙;當pH值小於6時,白煙消失,SO
2的吸收率降低。為提高吸收率,應不斷補給氨水以控制吸收液的pH值在6左右。氨吸收法生成的(NH
4)
2SO
3和 NH
4HSO
3經氧化可得(NH
4)
2SO
4。對吸收SO
2後的吸收液採用不同的處理方法,可回收不同
副產物。
根據回收的副產物不同,氨吸收法可分為:①氨-
硫酸銨法:在吸收液中加入
氨水可生成
(NH4)2SO3,在氧化塔中用空氣加壓氧化,可回收(NH
4)
2SO
4;在吸收液中加入H
2SO
4,則得到(NH
4)
2SO
4,並回收濃SO2。②氨-石膏法:用氨水調整吸收液的pH值,在氧化生成(NH
4)
2SO
4的溶液中加入Ca(OH)
2生成CaSO
4和氨水,氨水為吸收劑可循環使用。③蒸汽
解吸法:吸收液減壓加熱使NH
4HSO
3分解,生成(NH
4)
2SO
3,同時回收濃SO
2。分離出(NH
4)
2SO
3結晶後的溶液返回作循環吸收液。④氨-
硫磺回收法:加熱使吸收液濃縮,可分解出SO
2、NH3和水蒸汽的
混合氣體,在混合氣中加入還原氣體H
2S,可回收單體硫。
石灰石或
石灰乳吸收法:以CaCO
3粉末和Ca(OH)
2為吸收劑脫去煙氣中的SO
2,副產物為CaSO
4·2H
2O。石灰乳吸收法對SO
2的吸收效率取決於吸收液的pH值和吸收時
液氣比。如吸收液pH值近於6,液氣比大於4,
脫硫率達90%以上。石灰乳濃度通常為5~15%,石灰乳濃度增高,吸收速度降低。
對健康的威脅
二氧化硫具有酸性,可與空氣中的其他物質反應,生成微小的亞硫酸鹽和硫酸鹽顆粒。當這些顆粒被吸入時,它們將聚集於肺部,是呼吸系統症狀和疾病、呼吸困難,以及過早死亡的一個原因。如果與水混合,再與皮膚接觸,便有可能發生凍傷。與眼睛接觸時,會造成紅腫和疼痛。
治理方法
排煙脫硫從燃料燃燒或工業生產排放的廢氣中去除SO
2的技術出現於19世紀 80年代。1884年英國有人用
石灰水在
洗滌塔中吸收燃燒
硫磺形成的SO
2,回收
硫酸鈣。1897年日本本山冶煉廠用
石灰乳[Ca(OH)]
2脫除有色金屬冶煉煙氣中高濃度SO
2(SO
2濃度大於3%),脫硫率為21~23%。1930年英國倫敦電力公司完成了用水洗法脫除煙氣中低濃度SO
2(SO
2濃度小於3%)的研究工作,並在
泰晤士河南岸巴特西電站,建造一套用泰晤士河水調製
白堊料漿洗滌
煙道氣中SO
2的裝置。
新的排煙
脫硫技術,如冷凍
脫硫、海水脫硫、電子射線脫硫和
膜分離技術脫硫,以及從煙氣中同時脫除硫氧化物和
氮氧化物等正在探索中。
燃料脫硫 大氣的SO
2污染主要是含硫燃料燃燒造成的。為防止污染,可使用低硫燃料。一般來說淨化後的
氣體燃料(如低硫天然氣、
焦爐煤氣、
高爐煤氣和
發生爐煤氣)都是低硫燃料,直接燃燒基本上不會造成SO
2污染。
固體燃料和液體燃料的
含硫量因產地而異。一噸煤含5~50公斤硫;一噸原油含5~30公斤硫,
重油的含硫量高於
原油1.5~2倍。燃燒形成的SO
2為可燃硫量的2倍。因此,預先對燃料脫硫,是防止大氣硫氧化物污染的基本方法之一。
高煙囪排放 利用自然淨化能力控制煙氣中SO
2對
環境污染的方法。高
煙囪排放有利於煤煙中二氧化硫在大氣中的擴散稀釋。煙囪越高,平均風速越大,擴散
稀釋作用越強。這一方法為許多國家採用。但高煙囪排放並不能減少排出的
污染物總量,只是由於
大氣湍流的擴散稀釋作用,降低了SO
2等污染物的濃度。自然界的淨化能力有一定限度,隨著污染物總量增多,就會在某種氣象條件下出現區域性的環境質量惡化,甚至會引起相鄰的地區和國家下。加拿大建有世界上最高的排放煤煙的煙囪,高385.5米。
 硫氧化物
硫氧化物 硫氧化物
硫氧化物 二氧化硫的三種共振結構,中央的共振結構對混成體之貢獻最大
二氧化硫的三種共振結構,中央的共振結構對混成體之貢獻最大 硫氧化物
硫氧化物