命名
根據取代鹵素的不同,分別稱為氟代烴、氯代烴、溴代烴和碘代烴;也可根據分子中鹵素
原子的多少分為一鹵代烴、二鹵代烴和
多鹵代烴;也可根據
烴基的不同分為飽和鹵代烴、不飽和鹵代烴和芳香鹵代烴等。此外,還可根據與鹵原子直接相連
碳原子的不同,分為一級鹵代烴RCH
2X、二級鹵代烴R
2CHX和三級鹵代烴R
3CX。
性質
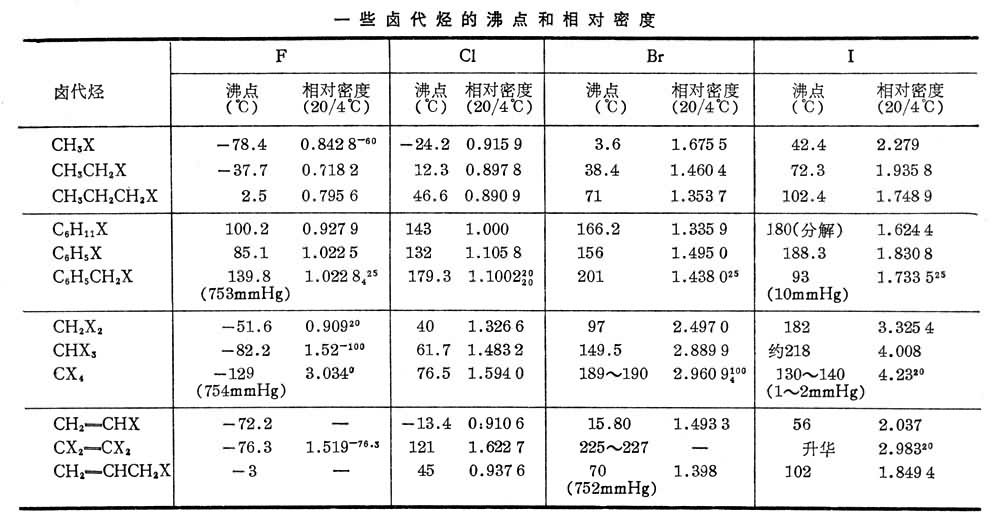
物理性質
基本上與烴不相似,CH
3F、CH
3CH
2F、CH
3Cl、CH
3Br在常溫下是氣體,余者低級為液體,高級的是固體。它們的
沸點隨分子中碳原子和鹵素原子數目的增加(氟代烴除外)和鹵素
原子序數的增大而升高。
密度隨碳原子數增加而降低。一氟代烴和一氯代烴的密度一般比水小,溴代烴、碘代烴及多鹵代烴密度比水大。絕大多數鹵代烴不溶於水或在水中
溶解度很小,但能溶於很多
有機溶劑,有些可以直接作為溶劑使用。鹵代烴大都具有一種特殊氣味,多鹵代烴一般都難燃或不燃。
 鹵代烴
鹵代烴化學性質
鹵代烴是一類重要的有機合成中間體,是許多有機合成的原料,它能發生許多化學反應,如
取代反應、
消去反應等。鹵代烷中的鹵素容易被—OH、—OR、—CN、NH
3或H
2NR取代,生成相應的
醇、
醚、
腈、
胺等化合物。
一般反應式可寫為:R─X+:Nu®-Nu+:X
脂肪族鹵代烴可在鹼性水溶液中
水解生成醇,鹼性醇溶液中發生消去反應生成烯,芳香族鹵代烴則較為困難。
合成
簡單的鹵代烴,如氯(代)
甲烷、
二氯甲烷等,多是在高溫或光照條件下由
烷烴直接發生取代反應製得。結構複雜的鹵代烴則多由相應的
醇或
不飽和烴製得。
對於一鹵代烴而言,通常用醇、烴來製取:
(1)由醇製取:是普遍採用的經典方法。常用的試劑有氫鹵酸、鹵化磷及
氯化亞碸(SOCl
2,或稱
亞硫醯氯)。
A.醇與氫鹵酸作用:
ROH+HX®RX+H2O
這是一個可逆反應。為了使反應完全,設法從反應中不斷地移去水,可以提高產率,例如在製備氯代烴時,採用乾燥
氯化氫氣體在無水氯化鋅存在下通入醇中;製備溴代烴時,是將
溴化鈉與
濃硫酸的
混合物與醇共熱;製備碘代烴時,將醇與
氫碘酸一起回流。值得一提的是,這並不是一種合成鹵烴的好方法。主要是因為有些醇在反應過程中會發生重排,生成混合產物。
B.醇與鹵化磷作用。醇與鹵化磷作用,可以製備氯代烴、溴代烴和碘代烴。製備溴代烴或碘代烴常用
三溴化磷或三
碘化磷。例如:
3C2H5OH+PBr3®3C2H5Br+P(OH)3
3C4H9OH+PI3®3C4H9I+P(OH)3
所用的三鹵化磷是用赤磷和溴或碘直接加入醇中反應。
製備氯代烴一般不採用
三氯化磷,常因生成
亞磷酸酯而使產率只能達到50%左右:
3ROH+PCl3®P(OR)3+3HCl
ROH+PCl5®RCl+POCl3+HCl
C.醇與氯化亞碸(SOCl2)作用。這是製備氯代烴最常用的方法之一。
ROH+SOCl2®RCl+SO2+HCl
反應生成的副產物都是氣體,容易除去,故產品純度高,產率可達90%左右。
工業生產也多採用此法。
(2)用烴製備
A.飽和烴發生取代反應:CH4 + Cl2 ® CH3Cl + HCl
B.不飽和烴發生加成反應:CH2=CH2 + HBr ® CH3CH2Br
反應
1.取代反應
由於鹵素原子吸引電子的能力大,致使鹵代烴分子中的C—X鍵具有一定的極性。當C—X鍵遇到其他的極性試劑時,鹵素原子被其他原子或原子團取代。
(1)被羥基取代
鹵代烴與水作用可生成醇。在反應中,鹵代烴分子中的鹵原子被水分子中的羥基所取代:
R—X+HOH®R—OH+HX
該反應進行比較緩慢,而且是可逆的。如果用強鹼的水溶液來進行水解,這個反應可向右進行,原因是在反應中產生的鹵化氫被鹼中和掉,而有利於反應向水解方向進行。
R—X+NaOH®R—OH+NaX
鹵素與苯環相連的鹵代芳烴,一般比較難水解。如氯苯一般需要高溫高壓條件下才能水解。
(2)被烷氧基取代
鹵代烴與醇鈉作用,鹵原子被烷氧基(RO—)取代生成醚,這是製取混合醚的方法。
RX+R′ONa®ROR′+NaX
例:CH3Br+CH3CH2ONa®H3C—O—CH2CH3(甲乙醚)+NaBr
(3)被氰基取代
鹵代烴與氰化鈉(或氰化鉀)的醇溶液共熱,鹵原子被氰基取代生成腈。
RX+NaCN®RCN+NaX
生成的腈分子比原來的鹵代烴分子增加了一個碳原子,這在有機合成中作為增長碳鏈的一種方法。
2.消除反應
鹵代烷在鹼的醇溶液中加熱,可脫去一個鹵化氫分子,形成烯烴。
RCH2CH2X+KOH®RCH=CH2+KX+H2O
3.與金屬作用
鹵代烴能與多種金屬作用,生成金屬有機化合物,其中格氏試劑是金屬有機化合物中最重要的一類化合物,是有機合成中非常重要的試劑之一。它是鹵代烷在無水乙醚中與金屬鎂作用,生成的有機鎂化合物,再與活潑的鹵代烴如烯丙型、苄基鹵代烴偶合,形成烴。
RX+Mg®RMgX
CH2=CHCH2Cl+RMgCl®CH2=CHCH2R+MgCl2
C6H5CH2Cl+CH2=CH—CH2MgCl®C6H5CH2CH2CH=CH2+MgCl2
鹵代烷與金屬鈉作用可生成烷烴,利用這個反應可以製備高級烷烴。
2RBr+2Na®R—R+2NaBr
套用
許多鹵代烴可用作滅火劑(如
四氯化碳)、冷凍劑(如
氟利昂)、清洗劑(常見乾洗劑、機件洗滌劑)、麻醉劑(如
氯仿,現已不使用)、殺蟲劑(如
六六六,現已禁用),以及高分子工業的原料(如
氯乙烯、
四氟乙烯)。在有機合成上,由於鹵代烴的化學性質比較活潑,能發生許多反應,例如取代反應、消去反應等,從而轉化成其他類型的化合物。因此,引入鹵原子常常是改變分子性能的第一步反應,在有機合成中起著重要的橋樑作用。如:
 重要的鹵代烴—氟利昂
重要的鹵代烴—氟利昂1、在烴分子中引入
羥基。例如由苯制
苯酚。先用苯與
氯氣在有鐵屑存在的條件下發生取代反應製取
氯苯,在用氯苯在
氫氧化鈉存在的條件下與
高溫水蒸氣發生水解反應便得到苯酚;再例如由乙烯制乙二醇。先用乙烯與氯氣發生
加成反應制1,2-
二氯乙烷,再用1,2-二氯乙烷再氫氧化鈉溶液中發生水解反應製得乙二醇。
2、在特定碳原子上引入鹵原子。例如,由1-溴
丁烷制1,2-二溴丁烷。先由1-
溴丁烷發生消去反應得1-丁烯,再由1-丁烯與溴加成得1,2-二溴丁烷。
3、改變某些
官能團的位置。例如,由1-
丁烯制2-丁烯。先由1-
丁烯與氯化氫加成得2-
氯丁烷,再由2-氯丁烷發生消去反應得2-丁烯;如由
1-溴丙烷制2-溴丙烷。先由1-
溴丙烷通過消去反應制
丙烯,再由丙烯與溴化氫加成得2-溴丙烷;由1-
丙醇制2-丙醇。先由1-丙醇消去反應制丙烯,再由丙烯與氯化氫加成制2-
氯丙烷,最後由2-氯丙烷水解得2-丙醇。
(1).水解反應。
(2).消去反應。
毒性
鹵素是強
毒性基,鹵代烴一般比母體烴類的毒性大。鹵代烴經皮膚吸收後,侵犯神經中樞或作用於內臟器官,引起中毒。一般來說,碘代烴毒性最大,溴代烴、氯代烴、氟代烴毒性依次降低。低級鹵代烴比高級鹵代烴毒性強;飽和鹵代烴比不飽和鹵代烴毒性強;多鹵代烴比含鹵素少的鹵代烴毒性強。使用鹵代烴的工作場所應保持良好的通風。
中毒
臨床表現
(1)輕度中毒:接觸低濃度氯丁二烯,可引起強烈的刺激症狀,出現眼結膜充血、流淚、咳嗽、胸痛,以及頭痛、頭暈、嗜睡、噁心、嘔吐等症狀。
(2)重度中毒:吸入高濃度氯丁二烯,可引起嚴重嘔吐、煩躁不安、興奮、抽搐、血壓下降、肺水腫、休克。嚴重者迅速陷入昏迷。
(3)長期接觸可致毛髮脫落,發生接觸性皮炎,結膜炎,角膜周邊性壞死以及貧血和腎臟損害。實驗室檢查:血中谷胱甘肽(GSH)明顯減少可作診斷中毒的參考。另尿中可出現蛋白質,外周血紅細胞、白細胞、血小板可下降,網織紅細胞增多。
急診處理
1.迅速移離中毒場所,清洗污染的皮膚。
2.吸氧。
3.必要時,給予呼吸興奮劑,呼吸停止者應立即口對口人工呼吸。
4.以10%硫代硫酸鈉10ml靜脈注射。
5.及時防治肺水腫及保肝治療。重視對症治療。
檢驗方法
①將鹵代烴與過量NaOH溶液混合(加熱),充分振盪、靜置;
②然後再向混合溶液中加入過量的稀HNO3以中和過量的NaOH;
③最後,向混合液中加入AgNO3溶液,若有白色沉澱生成則證明是氯代烴;若有淺黃色沉澱生成,則證明是溴代烴;若有黃色沉澱生成,則證明是碘代烴。
 鹵代烴
鹵代烴 重要的鹵代烴—氟利昂
重要的鹵代烴—氟利昂
 鹵代烴
鹵代烴 重要的鹵代烴—氟利昂
重要的鹵代烴—氟利昂