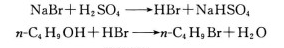理化性質,物理性質,化學性質,製備方法,工業製法,其他製法,套用領域,安全措施,健康危害,急救措施,風險術語,安全術語,儲存運輸,質量標準,技術條件,檢驗規則,重大事件,
理化性質
物理性質
1.性狀:無色立方晶系晶體或白色顆粒狀粉末。無臭,味鹹而微苦。
2.密度(g/mL,25ºC):3.203;
3.熔點(ºC):755;
4.沸點(ºC,常壓):1390;
5.折射率:1.6412;
6.閃點(ºC):1390。
7.溶解性:易溶於水(20ºC時溶解度為90.5g/100ml水,100ºC時溶解度為121g/100ml水),水溶液呈中性,有導電性。微溶於醇,可溶於乙腈,乙酸。
8.蒸汽壓(806ºC):1mmHg。
化學性質
1.51℃時溴化鈉溶液中析出無水溴化鈉結晶,低於51ºC則生成二水物。
NaBr+2H2O=NaBr·2H2O(T<51ºC)
2.溴化鈉能被氯氣置換出溴單質。
2Br-+Cl2=Br2+2Cl-
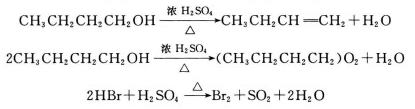
3.溴化鈉與濃硫酸等反應生成溴,即在強氧化性酸作用下,溴化鈉能被氧化,游離出溴。
2NaBr+3H2SO4(濃)=2NaHSO4+Br2+SO2↑+2H2O
4.溴化鈉可與稀硫酸反應生成溴化氫。
NaBr+H2SO4=HBr+NaHSO4
5.水溶液中,溴化鈉能與銀離子反應生成淺黃色固體溴化銀。
Br-+Ag+=AgBr↓
6.電解熔融狀態的溴化鈉生成溴氣和金屬鈉。
2NaBr=通電2Na+Br2↑
7.溴化鈉水溶液通電電解可以生成溴酸鈉和氫氣。
NaBr + 3H2O=電解NaBrO3 + 3H2↑
8.可發生有機反應,如製取溴乙烷的主反應:
NaBr+H2SO4+CH2CH2OH⇌NaHSO4+CH3CH2Br+H2O
製備方法
工業製法
1.把微過量的溴,直接加入飽和氫氧化鈉熱溶液中,生成溴化物和溴酸鹽的混合物:
3Br2+6NaOH=5NaBr+NaBrO3+3H2O
將此時的混合物蒸發至乾,所得到的固體殘渣與碳粉混合加熱,把溴酸鹽還原為溴化物:
NaBrO3+3C=NaBr+3CO↑
最後用水溶解,再過濾結晶,於110至130攝氏度乾燥即得。
這種方法是溴製備溴化物的一般方法,工業上一般採用。
2.中和法:使用
碳酸氫鈉為原料:將碳酸氫鈉溶於水,然後用35%—40%
氫溴酸進行中和,反應得到溴化鈉溶液,濃縮後冷卻,析出二水合溴化鈉。過濾,用少量水溶解二水合物,滴加溴水至剛出現溴的顏色。加熱,用硫化氫水溶液脫色,煮沸。在高溫時析出無水物結晶,乾燥後移入乾燥器,於110保持1小時。然後在裝有溴化鈣乾燥劑的保乾器中冷卻,得無水溴化鈉(試劑級)。
反應原理:HBr+NaHCO3→NaBr+CO2↑+H2O
以40%液鹼為原料:將氫溴酸放入反應鍋中,在不斷攪拌下,緩慢加入40%液鹼溶液,中和至pH7.5—8.0,反應生成溴化鈉溶液。將溴化鈉液離心過濾,濾入稀溴化鈉液貯存槽內。然後打入蒸發罐內濃縮,中間補料1—2次,到比重為1. 55°Be左右時,離心過濾,濾入濃溴化鈉液貯存槽內。然後壓入結晶罐,在攪拌下冷卻結晶,再將結晶離心分離,即得成品。母液返回稀溴化鈉液貯存槽內。
反應原理:HBr+NaOH→NaBr+H2O
3.尿素還原法:在化鹼槽中,將純鹼溶於熱水中,溫度50—60°C,再加入尿素,溶解得21°Be溶液。然後轉入還原反應鍋,緩緩通入溴素,控制反應溫度75—85°C,至pH達6—7時,即達反應終點,停止通溴和攪拌,得到溴化鈉溶液。
用氫溴酸調pH至2,再用尿素、氫氧化鈉調pH至6—7,以除去溴酸鹽。將溶液加熱至沸,在pH6—7時加入溴化鋇飽和溶液以除去硫酸鹽。若鋇鹽過量,可加稀硫酸除去。去雜後的反應物料加活性炭,放置4—6小時,待溶液澄清後,吸濾,常壓蒸發,中間補料若干次,在取結晶前2小時停止加料。取結晶前1小時調pH達6—7。分離,於轉筒乾燥器乾燥得溴化鈉。
反應原理:3Br2+3Na2CO3+NH2CONH2=6NaBr+4CO2↑+N2↑+2H2O
其他製法
將鐵與溴直接作用生成
溴化亞鐵再與
碳酸鈉共沸得到。副產物是鹼式碳酸亞鐵,於煮沸後變成亞鐵及高鐵的膠態化合物,過濾極慢。為了避免此缺點,最好將溴兩次加入,最後得到的主要是鐵的氧化物,因此過濾與洗淨都很容易,反應如下:
Fe+Br2→FeBr2
FeBr2+Br2→FeBr2·FeBr3
FeBr2·FeBr3+Na2CO3→NaBr+FeO·Fe2O3+CO2↑
套用領域
1.感光工業用於配製膠片感光液。
2.醫藥上用於生產利尿劑和鎮靜劑,用於治療神經衰弱、神經性失眠、精神興奮狀態等。鎮靜藥在體內解離出溴離子,對中樞神經系統具有輕度的抑制作用,可使興奮不安的雞隻安靜下來。內服易吸收,但排泄緩慢。用於緩解雞隻因轉群、斷喙、藥物注射、免疫接種、捕捉、採血或藥物中毒等因素引起的應激。
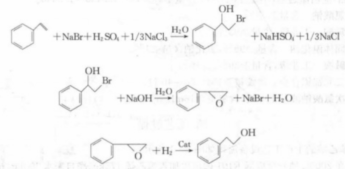
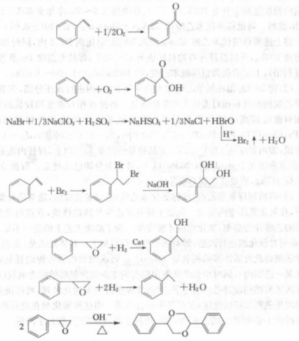
3.香料工業中用於生產合成香料,以醇類香料β—苯乙醇為例,合成過程如下:
主反應:
副反應:
4.印染工業中用作溴化劑。
5.還用於微量測定鎘,配製自動洗碟機用洗滌劑,製造溴化物,有機合成,照相紙版等方面。
有機合成如正溴丁烷的合成:
主反應:
副反應:
安全措施
健康危害
急性毒性(LD50):7000mg/kg(大鼠經口);3500mg/kg(兔經皮)
要防止攝入、吸入,防止眼睛、皮膚與之接觸。
水危害級別1:對水是稍微危害的,不要讓未稀釋或大量的產品接觸地下水,水道或者污水系統。
急救措施
要防止攝入、吸入,防止眼睛、皮膚與之接觸。如果攝入、吸入,會發生暈眩、噁心、嘔吐,要立即請醫生診治。如濺入眼中,要立即用新鮮水沖洗20min;皮膚接觸了溴化鈉,也要用大量水沖洗。
風險術語
R36: 刺激眼睛。
R37: 刺激呼吸系統。
R38: 刺激皮膚。
危險品標誌:Xi
安全術語
S24: 避免接觸皮膚。
S25: 避免接觸眼睛。
儲存運輸
1.應貯存在乾燥、陰涼、通風良好的地方。要防止日光曝曬,與火種和熱源隔離,不得與氨、氧、磷、銻粉和鹼類共貯混運。應遠離木屑、刨花、稻草等,以防燃燒。
2.失火時,可用沙土、二氧化碳滅火器撲救。
質量標準
根據中華人民共和國標準,化學試劑溴化鈉GB1265—77標準對溴化鈉進行檢測。
技術條件
1.NaBr含量不少於:
分析純:99.0%
化學純:98.0%
2.水溶液反應:合格。
3.雜質最高含量(指標以%計):
| 名稱 | 分析純 | 化學純 |
|---|
澄清度實驗 | 合格 | 合格 |
水不溶物 | 0.005 | 0.02 |
氯化物(Cl) | 0.2 | 0.5 |
溴酸鹽(BrO3) | 0.001 | 0.003 |
碘化物(I) | 0.02 | 0.05 |
硫酸鹽(SO4) | 0.002 | 0.005 |
氮化合物(N) | 0.001 | 0.002 |
鎂(Mg) | 0.0005 | 0.002 |
鈣(Ca) | 0.002 | 0.005 |
鐵(Fe) | 0.0002 | 0.0005 |
鋇(Ba) | 0.002 | 0.005 |
重金屬(以Pb計) | 0.0002 | 0.0005 |
檢驗規則
按GB619—77之規定進行取樣及驗收。
重大事件
2015年11月5日上午,長深高速濱州段3號口和4號口之間三輛車相撞,一輛罐車爆炸,一輛載有溴化鈉的危化品車發生泄露,三輛車都已經燒成骨架,致一人死亡。