無論是電子導體還是離子導體,根據物理化學理論,凡是固相顆粒同液相接觸,在其界面上必定產生偶電層,它是一封閉的均勻的偶電層,因而不形成外電場。其間的電位差稱為電極電位。
基本介紹
- 中文名:電極電位
- 性質:科學
- 類別:化學
- 解釋:金屬的表面與溶液間產生電位差
物理標準
物理套用
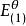
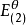
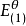
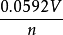
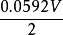
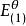
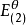
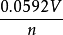
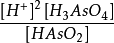
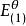
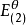

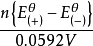
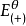
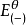
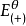
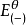
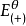
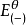
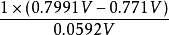
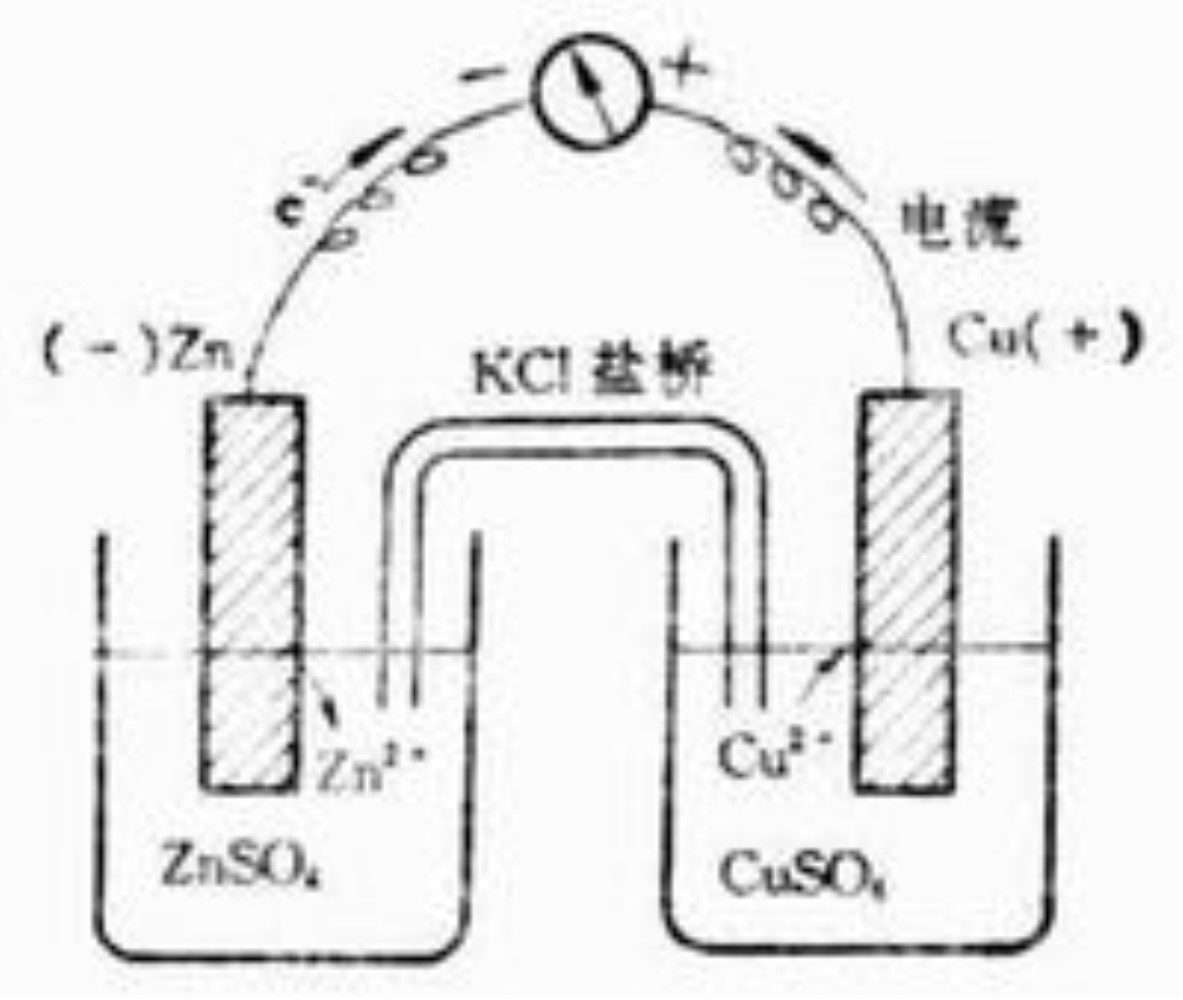
無論是電子導體還是離子導體,根據物理化學理論,凡是固相顆粒同液相接觸,在其界面上必定產生偶電層,它是一封閉的均勻的偶電層,因而不形成外電場。其間的電位差稱為電極電位。
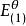
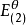
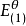
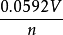
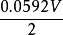
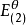
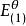
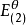
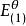
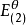
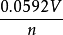
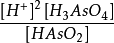
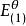
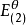

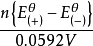
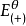
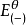
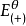
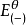
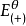
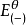
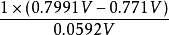
為了獲得各種電極的電極電勢數值,通常以某種電極的電極電勢作標準與其它各待測電極組成電池,通過測定電池的電動勢, 而確定各種不同電極的相對電極電勢( electrode ...
無論是電子導體還是離子導體,根據物理化學理論,凡是固相顆粒同液相接觸,在其界面上必定產生偶電層,它是一封閉的均勻的偶電層,因而不形成外電場。其間的電位差稱為...
標準電極電位,即標準電極電勢,指的是當溫度為25℃,金屬離子的有效濃度為1mol/L(即活度為1)時測得的平衡電位。非標態下的標準電極電位可由能斯特方程導出。...
標準電極電勢表,是指半反應按電極電勢由低到高排序,可十分簡明地判斷氧化還原反應的方向。標準電極電勢是可逆電極在標準狀態及平衡態時的電勢,也就是標準態時的...
電極電位金屬浸於電解質溶液中,顯示出電的效應,即金屬的表面與溶液間產生電位差,這種電位差稱為金屬在此溶液中的電位或電極電位。...
電位分析法(potenti ometry 是以測量原電池的電動勢為基礎,根據電動勢與溶液中某種離子的活度(或濃度)之間的定量關係(Nernst 方程式)來測定待測物質活度或濃度的...
氧化還原電位就是用來反映水溶液中所有物質表現出來的巨觀氧化還原性。氧化還原電位越高,氧化性越強,氧化還原電位越低,還原性越強。電位為正表示溶液顯示出一定的...
電極電位法測井是指在井中測量電子導電礦體電極電位的方法。電子導電性礦體和溶液接觸時,由於溶解壓和滲透壓的作用而在礦體表面出現電位躍變現象,此時在電子導體與...
標準電極電勢是可逆電極在標準狀態及平衡態時的電勢,也是標準態時的電極電勢。指的是當溫度為25℃,金屬離子的有效濃度為1mol/L(即活度為1)時測得的平衡電位。...
reference electrode 測量各種電極電勢時作為參照比較的電極。將被測定的電極與精確已知電極電勢數值的參比電極構成電池,測定電池電動勢數值,就可計算出被測定電極的...
過電位(英語:overpotential)是電極的電位差值。又叫超電勢。為一個電極反應偏離平衡時的電極電位與這個電極反應的平衡電位的差值,無電流通過(平衡狀態下)和有電流...
在分析化學中,條件電極電位(conditional electrode potential),簡稱條件電位。它是在一定,介質條件下,氧化態和還原態的總濃度均為1mol·L-1時,校正了各種因素影響...
靜態電極電位指無外電流通過時,金屬電極在電解液中的電極電勢。...... 靜態電極電位指無外電流通過時,金屬電極在電解液中的電極電勢。中文名稱 靜態電極電位 英文...
離子選擇電極又稱離子電極。一類利用膜電位測定溶液中離子活度或濃度的電化學感測器。1906年由R.克里默最早研究,隨後由德國哈伯(F.Harber)等人製成的測量溶液PH的...
極化電位就是電極在通過電流後的電極電位,分陽極極化電位和陰極極化電位。...... 極化電位就是電極在通過電流後的電極電位,分陽極極化電位和陰極極化電位。...
如果電極界面上存在著單獨一種氧化還原對的快速電子交換,即存在著交換電流很大的(見遷越超電勢)單一電極反應,這種電極能很快建立電化學平衡,稱為可逆電極。可逆電極...
在不可逆條件下,當有電流通過電極時,發生的是不可逆的電極反應,此時的電極電勢與可逆電極電勢會有所不同。電極在有電流通過時所表現的電極電勢與可逆電極電勢產生...
汞/氧化汞電極是鹼性溶液中常用的參比電極,標準電極電位為0.098V。...... 汞/氧化汞電極是鹼性溶液中常用的參比電極,標準電極電位為0.098V。中文名 汞/氧化汞電...
ZETA電位(Zeta potential)是指剪下面(Shear Plane)的電位,又叫電動電位或電動電勢(ζ-電位或ζ-電勢),是表征膠體分散系穩定性的重要指標。目前測量Zeta 電位的...
“參考電極”又稱“參比電極”。在測定一個電極的電極電位時,必須另配上一個已知電極電位電極使成為一個電池,測其電勢後,方可算出被測電極的電極電位。這樣配...
