基本介紹
簡介
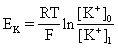 平衡電位式
平衡電位式平衡電位的推導

式中J——流量;

根據斯托克-愛因斯坦方程(Stroke-Einstein equation),D與u之間存在如下關係:

平衡狀態時,淨流量J等於0,於是有:

此式求積分,可得如下能斯特平衡方程:
突觸後電位的平衡
電化學平衡
實際套用
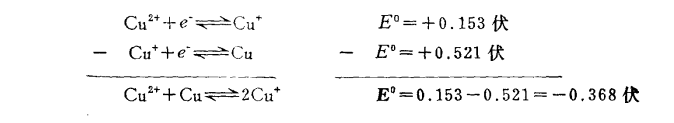 電極反應式
電極反應式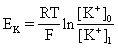 平衡電位式
平衡電位式



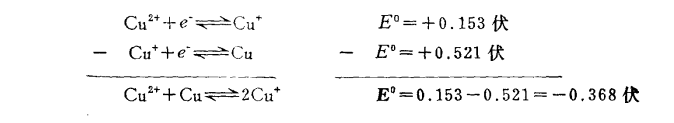 電極反應式
電極反應式平衡電位(equilibrium potential)指靜息條件下細胞膜內外的電位差。細胞膜內外的鉀離子濃度內高外低,存在濃度梯度,而細胞膜可允許鉀離子透出膜外。當鉀離子外移開始...
平衡電極電位,也稱可逆電極的電位。在一個可逆電極中,金屬成為陽離子進入溶液以及溶液中的金屬離子沉積到金屬表面的速度相等時,反應達到動態平衡,亦即正逆過程的物質...
鈉平衡電位(sodium equilibrium potential)是指膜內電位達到+40毫伏,鈉離子不能再進入細胞膜時的電位。神經細胞膜上有許多小孔,稱離子通道,在靜息狀態下,對鉀離子...
標準電極電位,即標準電極電勢,指的是當溫度為25℃,金屬離子的有效濃度為1mol/L(即活度為1)時測得的平衡電位。非標態下的標準電極電位可由能斯特方程導出。...
無論是電子導體還是離子導體,根據物理化學理論,凡是固相顆粒同液相接觸,在其界面上必定產生偶電層,它是一封閉的均勻的偶電層,因而不形成外電場。其間的電位差稱為...
鈣電位 calcium potential是Ca2+的平衡電位。在某種興奮時Ca2+的通透性增加的細胞中,與Ca2+相應的平衡電位的臨近點所出現的動作電位的峰值或階躍就是鈣電位。由於...
沉積電位是指在平衡電位以上發生電沉積現象時的電位,其中最常見的是金屬離子沉積為金屬。目前認為,電勢沉積是發生沉積的金屬與電極表面的底物之間強相互作用的結果。...
電位分析法(potenti ometry 是以測量原電池的電動勢為基礎,根據電動勢與溶液中某種離子的活度(或濃度)之間的定量關係(Nernst 方程式)來測定待測物質活度或濃度的...
過電位(英語:overpotential)是電極的電位差值。又叫超電勢。為一個電極反應偏離平衡時的電極電位與這個電極反應的平衡電位的差值,無電流通過(平衡狀態下)和有電流...
陰極保護是使腐蝕微電池作用被迫停止所需要的陰極電位。...... 最小保護電位:使金屬的總電位達到其腐蝕微電池陽極的平衡電位。獲取陰極保護系統所需要的電流值...
電子自動平衡儀表是一種帶記錄的模擬式顯示儀表。電子自動平衡儀表因使用時所連線的測量元件(熱電偶和熱電阻等)不同而分為電子自動平衡電位差計和電子自動平衡電橋...
①等級性。指局部電位的幅度與刺激強度正相關,而與膜兩側離子濃度差無關,因為離子通道僅部分開放無法達到該離子的電平衡電位,因而不是“全或無”式的。②可以總和...
標準電極電勢是可逆電極在標準狀態及平衡態時的電勢,也是標準態時的電極電勢。指的是當溫度為25℃,金屬離子的有效濃度為1mol/L(即活度為1)時測得的平衡電位。...
