基本介紹
- 中文名:標準電極電勢
- 外文名:Standard Electrode Potential (SEP)
- 別名:標準電極電位
- 性質:電勢
- 電位值:規定為0
概念
標準氫電極
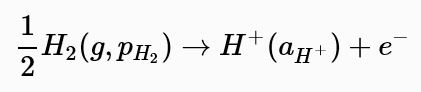
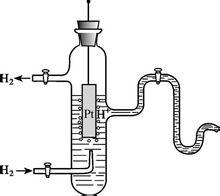 標準氫電極
標準氫電極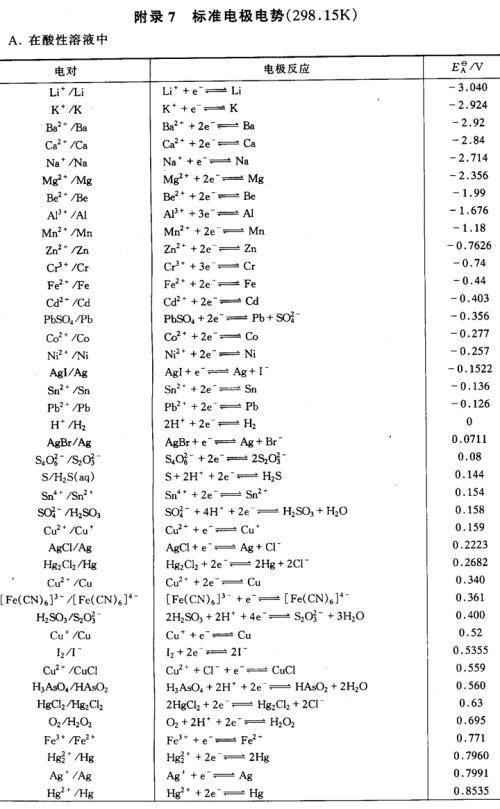
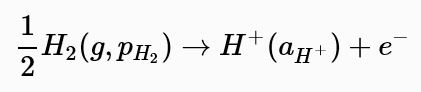
 標準氫電極
標準氫電極標準電極電勢表,是指半反應按電極電勢由低到高排序,可十分簡明地判斷氧化還原反應的方向。標準電極電勢是可逆電極在標準狀態及平衡態時的電勢,也就是標準態時的...
標準電極電位,即標準電極電勢,指的是當溫度為25℃,金屬離子的有效濃度為1mol/L(即活度為1)時測得的平衡電位。非標態下的標準電極電位可由能斯特方程導出。...
標準電極電勢是可逆電極在標準狀態及平衡態時的電勢,也是標準態時的電極電勢。指的是當溫度為25℃,金屬離子的有效濃度為1mol/L(即活度為1)時測得的平衡電位。...
電極電勢是電極中極板與溶液之間的電勢差。為了獲得各種電極的電極電勢數值,通常以某種電極的電極電勢作標準與其它各待測電極組成電池,通過測定電池的電動勢, 而確定...
標準性電極電勢指的是當溫度為25℃,金屬離子的有效濃度為1mol/L(即活度為1)時測得的平衡電位。非標態下的標準電極電位可由能斯特方程導出。在M^+ne/M電極...
標準電極電位是以標準氫原子作為參比電極,即氫的標準電極電位值定為0,與氫標準電極比較,電位較高的為正,電位較低者為負。如氫的標準電極電位H2←→H+ 為0....
標準電極電位是以標準氫原子作為參比電極,即氫的標準電極電位值定為0,與氫標準電極比較,電位較高的為正,電位較低者為負。如氫的標準電極電位H2←→H+ 為0....
“參考電極”又稱“參比電極”。在測定一個電極的電極電位時,必須另配上一個已知電極電位電極使成為一個電池,測其電勢後,方可算出被測電極的電極電位。這樣配...
reference electrode 測量各種電極電勢時作為參照比較的電極。將被測定的電極與精確已知電極電勢數值的參比電極構成電池,測定電池電動勢數值,就可計算出被測定電極的...
由於單個電極的電勢無法確定,故規定任何溫度下標準狀態的氫電極的電勢為零,任何電極的電勢就是該電極與標準氫電極所組成的電池的電勢,這樣就得到了“氫標”的電極...
氫標電極電勢electrode }tcntial :}imst s}anc}}zTl l}yrlrc}en ekxt xcrJe規定標準氫尾極的電勢在任何溫度下恆為零,以此確 定各電極電勢的相對值,稱為氫...
元素電勢圖,大多數非金屬元素和過渡元素可以存在幾種氧化態,各氧化態之間都有相應的標準電極電勢,拉提默(Latimer)提出將它們的標準電極電勢以圖解方式表示,這種圖稱...
由於單個電極的電勢無法測量,通常借用標準氫電極作為參考電極來測定電極的相對電動勢值。但是標準氫電極雖然穩定,但操作麻煩,所以常用重現性好、又比較穩定的甘汞電極...
氯化銀電極是由表面覆蓋有氯化銀的多孔金屬銀浸在含Cl-的溶液中構成的電極。氯化銀電極可表示為Ag/AgCl/Cl-,電極反應為AgCl+e=Ag+Cl-。氯化銀電極電勢穩定,...
平衡電極電位的數值主要決定於金屬的本性,同時又與溶液的濃度、溫度等因素有關。當參加電極反應的物質處於標準狀態下,即溶液中含該種金屬的離子活度為1、溫度為298...
經過測量氫鋅電池和銅鋅電池的電動勢,得到鋅的標準電極電勢為-0.763V,銅的標準電極電勢為+0. 34V。因此,鋅的還原能力強,而銅離子的氧化能力強。還原劑失掉...
條件電位的大小反映了在外界因素影響下,氧化還原電對的實際氧化還原能力。套用條件電位比用標準電極電位能更正確地判斷氧化還原反應的方向、次序和反應完成的程度。中文...
在電化學中,能斯特(Nernst)方程用來計算電極上相對於標準電勢(E0)來說的指定氧化還原對的平衡電壓(E)。能斯特方程只能在氧化還原對中兩種物質同時存在時才有意義...
人們所測得可逆電極的平衡電位,習慣上稱為電極電位。標準電極電位數值可通過熱力學有關平衡公式計算出來。當電極與溶液之間,電子轉移不平衡或物質交換不平衡,或者並...
原因何在?原因就是H2在Zn極板上析出時的超電壓很大(-0.77V),Zn的標準電極電勢為-0.76V,比H2在鋅上的超電勢數值大,所以Zn會優先析出,在極板上沉積。...
能斯特方程,是指用以定量描述某種離子在A、B兩體系間形成的擴散電位的方程表達式。在電化學中,能斯特方程用來計算電極上相對於標準電勢而言的指定氧化還原對的平衡...
