“參考電極”又稱“參比電極”。在測定一個電極的電極電位時,必須另配上一個已知電極電位電極使成為一個電池,測其電勢後,方可算出被測電極的電極電位。這樣配上的已知電極電位的電極,稱為參考電極。如氫電極等。
基本介紹
- 中文名:參考電極
- 外文名:reference electrode
- 別稱:參比電極
- 作用:與指示電極形成電池測定電動勢
- 類型:氫電極、甘汞電極、氯化銀電極
- 學科:分析化學
基本概述,標準氫電極,飽和甘汞電極,銀-氯化銀電極,銅-硫酸銅電極,
基本概述
“參考電極”又稱“參比電極”。由於單個電極的電極電位無法直接測出,所以在測定一個電極的電極電位時,必須另配上一個已知電極電位的電極,使成為一個電池。在測定此電池的電動勢後,才可以標出被測電極的電極電位。此種配上的已知電極電位的電極,稱為“參考電極”。一級參比電極的電極電位 一般取為零。以標準氫電極(SHE)為一級參比電極而測出的電極電位稱為“氫標電極電位”或標準電極電位。常用的二級參比電極有甘汞電極與氯化銀電極,它們的氫標電極電位均已精確測定,因此欲測電極與它們配對組成電池後,可以很方便地由測定的電池電動勢算得它的氫標電極電位。汞電極是另一種一級參比電極, 它規定電極上的電荷相對於溶液為零時的 電極電位為零,以之測得的電極電位稱為 “絕對電位”,這種電極較少套用。
標準氫電極
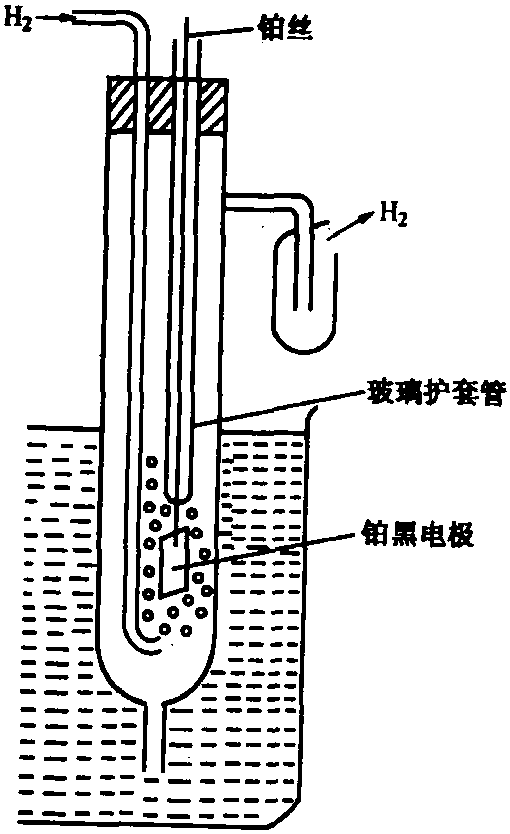
氫電極由氫氣吸附在金屬鉑表 面而構成。為了增加氫的吸附率和增大電極表面積,在 鉑上鍍以鉑黑(即高分散度的鉑)。具體說,實驗室中使用的氫電極是這樣製作的:將1平方厘米正方形鉑片(或鉑黑)與一根鉑絲相焊接,然後將大部分鉑絲封結在玻璃 套管中。鉑絲上端在使用中露出液面,以便進行電連 接。將上述鉑電極放入盛有酸性或鹼性溶液的一粗玻璃管中,並向管中通入純氫氣,即構成氫電極。如圖1所示。
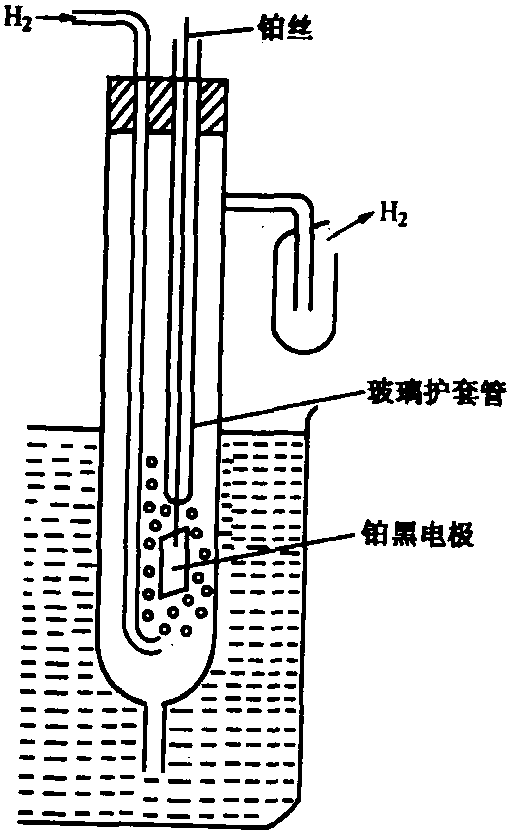 標準氫電極
標準氫電極氫電極上的電極反應為:
酸性溶液中 2 +2e⇌H2
+2e⇌H2

鹼性溶液中 2H2O+2e⇌H2+2OH
氫電極的電極電位與溶液的pH值、氫氣壓等有 關。令標準氫電極所處溶液的pH值等於零(即氫離子活度等於1)、氫氣的壓力為101325Pa(即1atm)。在以上標準條件下,標準氫電極的電極電位等於零,其數值與溶液溫度無關。
飽和甘汞電極
飽和甘汞電極由甘汞電極由汞、甘汞和KCl溶液等構成。在電極內部有一根小玻璃管,管內的上部放置汞,它通過封在玻璃管內的鉑絲與外部的導線相通。 汞的下面放置汞和甘汞生成的糊狀物。為了防止其下落,小玻璃管下部用脫脂棉花塞住。將小玻璃管浸在 KCl溶液中。甘汞電極的下端用多孔性陶瓷封口,以減緩溶液的流出速度。
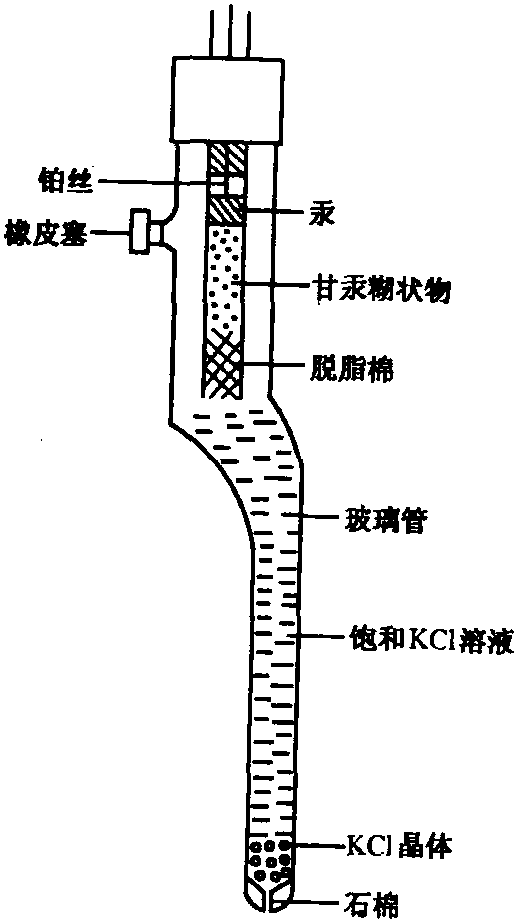 圖2 飽和甘汞電極
圖2 飽和甘汞電極甘汞電極的電極反應為:
Hg2Cl2+2e⇌2 +2
+2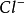

可見,甘汞電極的電極電位與溶液中氯離子濃度有關。飽和甘汞電極內的溶液採用飽和KCl溶液, 其電極電位等於0.2415V(SHE,25℃),當KCl的摩爾濃度為1mol/L,其電極電位為0.2801V(SHE,25℃),這種電極具有穩定的電極電位,結構簡單、製作容易等優點,在實驗室試驗中得到了廣泛套用。飽和甘汞電極的缺點是其電極電位對溫度十分敏感,尤其在溫度下降時滯後現象很嚴重,重新達到平衡要很長時間。
銀-氯化銀電極
銀-氯化銀電極由一根表面塗 復有AgCl的螺旋狀銀絲浸入含有Cl離子的溶液中 構成,如圖3所示。
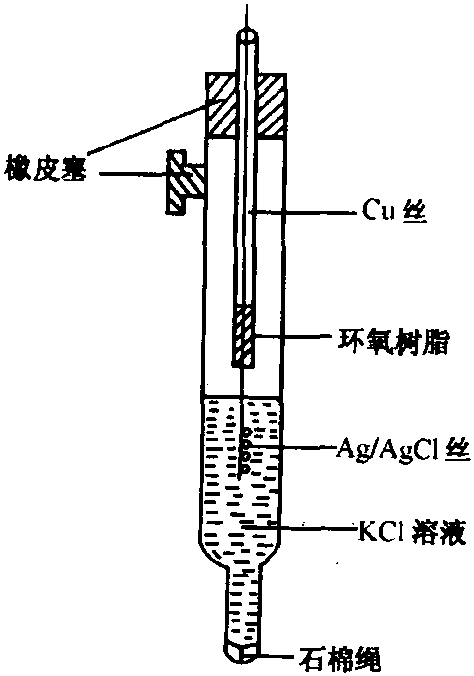 圖3 銀-氯化銀電極
圖3 銀-氯化銀電極銀-氯化銀電極的電極反應為:
AgCl+e⇌ +
+


在0.1mol/L的KCl溶液中,Ag/AgCl電極的電極電位等於0.2880V(SHE,25℃),銀-氯化銀電極的電極電位穩定,重現性好,而且結構簡單,使用方便,因此除在實驗室中套用外還廣泛用於船舶陰極保護。
銅-硫酸銅電極
銅-硫酸銅電極由一根銅棒 插在飽和硫酸銅溶液中構成,如圖4所示。
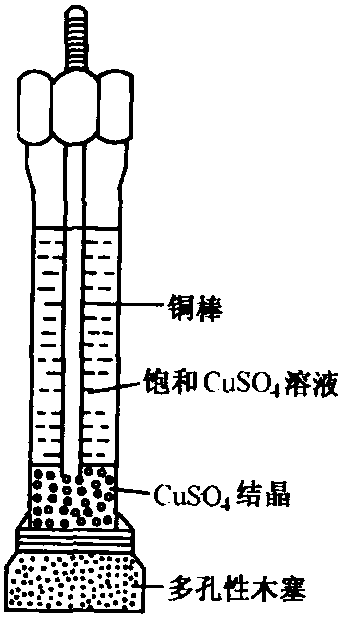 圖4 銅-硫酸銅電極
圖4 銅-硫酸銅電極銅-硫酸銅電極的電極反應為:
CuSO4+2e⇌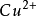 +
+
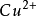

在飽和硫酸銅溶液中,Cu/CuSO4電極的電極電 位等於0.3160V(SHE,25℃)。銅-硫酸銅電極結構簡單,製作容易,堅固牢靠,是一種工業套用的簡易參比電極。鋼構築物在土壤中實施陰極保護時常採用 Cu/CuSO4電極進行電位監控。