電極反應是指在電極上發生的失去或獲得電子的電化學反應。失去電子的反應稱為氧化反應或陽極反應,發生該反應的電極稱為陽極;獲得電子的反應稱為還原反應或陰極反應,發生該反應的電極稱為陰極。
基本介紹
- 中文名:電極反應
- 外文名:electrode reaction
- 介質:電解池
- 定義:電極上的得失電子的電化學反應
- 包括:陽極反應、陰極反應
- 學科:電化學
基本概述
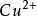
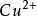

電極反應是指在電極上發生的失去或獲得電子的電化學反應。失去電子的反應稱為氧化反應或陽極反應,發生該反應的電極稱為陽極;獲得電子的反應稱為還原反應或陰極反應,發生該反應的電極稱為陰極。
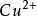
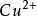
電極反應是指在電極上發生的失去或獲得電子的電化學反應。失去電子的反應稱為氧化反應或陽極反應,發生該反應的電極稱為陽極;獲得電子的反應稱為還原反應或陰極反應,...
電極反應式是指在電化學裝置中表示原子或離子在電極上得失電子發生氧化或還原反應的式子。...
如果電極界面上存在著單獨一種氧化還原對的快速電子交換,即存在著交換電流很大的(見遷越超電勢)單一電極反應,這種電極能很快建立電化學平衡,稱為可逆電極。可逆電極...
為了獲得各種電極的電極電勢數值,通常以某種電極的電極電勢作標準與其它各待測電極組成電池,通過測定電池的電動勢, 而確定各種不同電極的相對電極電勢( electrode ...
標準電極電位是以標準氫原子作為參比電極,即氫的標準電極電位值定為0,與氫標準...對於給定的電極而言,電極電位是一個確定的常量,對於下述電極反應:...
氯化銀電極是由表面覆蓋有氯化銀的多孔金屬銀浸在含Cl-的溶液中構成的電極。氯化銀電極可表示為Ag/AgCl/Cl-,電極反應為AgCl+e=Ag+Cl-。氯化銀電極電勢穩定,...
將化學能轉變為電能的裝置稱為原電池。在原電池中,發生的化學反應是氧化還原反應。發生氧化反應的一極上有電子流出,做負極,失去電子的物質是還原劑。電子通過原...
標準電極電位,即標準電極電勢,指的是當溫度為25℃,金屬離子的有效濃度為1mol/L(即活度為1)時測得的平衡電位。非標態下的標準電極電位可由能斯特方程導出。...
甘汞電極是常用的一種參比電極。由汞和氯化亞汞在氯化鉀水溶液中的飽和溶液相接觸而成。常用的甘汞電極有三種:氯化鉀溶液為飽和溶液的是飽和甘汞電極、氯化鉀溶液...
電極學是電化學的一個分支,它研究電極的各種平衡性質和動態行為。電極學主要講述電極學基礎、電極反應熱力學,電極過程動力學和電極反應工程學。...
一種氣體電極,如果以空氣代替氧,即為空氣電極。電極反應為2H2O+O2+4e-=4OH-,但此反應不易達平衡,故可逆氧電極難於實現。氧電極在電解水製取氧氣,研製氫/氧...
如果一電極的電極反應是可逆的,通過電極的電流非常小,電極反應是在平衡電位下進行的,這種電極稱為可逆電極。可逆電極的本質特徵主要有兩個,即單一電極和反應可逆。...
電極反應:一種化學反應電極反應:一款FLASH益智小遊戲...... 電極反應:一種化學反應 電極反應:一款FLASH益智小遊戲 V百科往期回顧 新手上路 成長任務 編輯入門 編輯規...
氧化還原電極是一種化學反應,是通過電子遷越金屬和溶液相界面來完成反應的電極。醌氫醌電極代表這一類。它的反應包括了氫醌一醌體系的可逆的氧化還原。鑒於它對...
基本信息遊戲名稱:電極反應 遊戲類型:益智小遊戲 遊戲大小:2316K遊戲介紹電流中正負極的正確連線很重要,不然就會造成短路。這款遊戲將幫你複習物理中的電流知識,...
氘的電極反應方程式如下:2D(aq) + 2e→ D2(g) 其電極電勢與氫的略有差異(約-0.013V,不同的文獻給出的數據各不相同,如也有-0.044V等說法)。...
電化學反應是屬於電化學範疇的化學反應。 電化學是有關電與化學變化關係的一個化學分支。電化學是邊緣學科,是多領域的跨學科。對“電化學”,古老的定義認為它是...
鉑是一種惰性貴金屬,常用作某些電極的電子導體,本身不參與電極反應,統稱鉑電極。...... 鉑是一種惰性貴金屬,常用作某些電極的電子導體,本身不參與電極反應,統稱鉑...
對電極也就是反電極,陰極材料。英語為counter electrode ,比如鉑對電極、碳對電極等。用的最多的就是Pt(鉑)對電極!...
標準電極電勢是可逆電極在標準狀態及平衡態時的電勢,也是標準態時的電極電勢。指的是當溫度為25℃,金屬離子的有效濃度為1mol/L(即活度為1)時測得的平衡電位。...
能斯特方程,是指用以定量描述某種離子在A、B兩體系間形成的擴散電位的方程表達式。在電化學中,能斯特方程用來計算電極上相對於標準電勢而言的指定氧化還原對的平衡...
通過氧化還原反應而產生電流的裝置稱為原電池,也可以說是把化學能轉變成電能的裝置。有的原電池可以構成可逆電池,有的原電池則不屬於可逆電池。原電池放電時,負極...
