通道簡介 活體細胞不停地進行新陳代謝活動,就必須不斷地與周圍環境進行
物質交換 ,而細胞膜上的離子通道就是這種物質交換的重要途徑。人們已經知道,大多數對生命具有重要意義的物質都是水溶性的,如各種離子,糖類等,它們需要進入細胞,而生命活動中產生的水溶性廢物也要離開細胞,它們出入的通道就是細胞膜上的離子通道。
生物膜離子通道 離子通道由細胞產生的特殊蛋白質構成,它們聚集起來並鑲嵌在細胞膜上,中間形成水分子占據的孔隙,這些孔隙就是水溶性物質快速進出細胞的通道。離子通道的活性,就是細胞通過離子通道的開放和關閉調節相應物質進出細胞速度的能力,對實現細胞各種功能具有重要意義。兩名德國科學家埃爾溫·內爾和貝爾特·扎克曼即因發現細胞內離子通道並開創
膜片鉗技術 而獲得1991年的諾貝爾生理學獎。
研究簡史 在生物電產生機制的研究中發現了生物膜對離子通透性的變化。1902年J.伯恩斯坦在他的膜學說中提出神經細胞膜對
鉀離子 有
選擇透過性 。1939年A.L.霍奇金與A.F.赫胥黎用
微電極 插入槍烏賊
巨神經纖維 中,直接測量到膜內外電位差。1949年A.L.霍奇金和B.卡茨在一系列工作基礎上提出膜電位離子假說,認為細胞膜動作電位的發生是膜對納離子通透性快速而特異性地增加,稱為“鈉學說”。尤其重要的是,1952年A.L.霍奇金和A.F.赫胥黎用
電壓鉗技術 在
槍烏賊 巨神經軸突上對細胞膜的離子電流和
電導 進行了細緻地定量研究,結果表明Na
+ 和K
+ 的電流和電導是膜電位和時間的函式,並首次提出了離子通道的概念。他們的模型 (H-H模型)認為,細胞膜的K
+ 通道受膜上4個帶電粒子的控制,當4個粒子在膜電場作用下同時移到某一位置時,K
+ 才能穿過膜。
另一方面,1955年,卡斯楚和B.卡茨對神經-肌肉接頭突觸傳遞過程的研究發現:突觸後膜
終板電位 的發生,是由於神經遞質乙醯膽鹼(Ach)作用於終板膜上受體的結果,從而確認了受
化學遞質 調控的通道。60年代,用各種
生物材料 對不同離子
通透性 的研究表明,各種離子在膜上各自有專一性的運輸機構,曾經提出運輸機構是載體、洞孔和離子交換等模型。1973年和1974年,C.M.阿姆斯特朗、F.貝薩尼利亞及R.D.凱恩斯、E.羅賈斯兩組分別在神經
軸突 上測量到與離子通道開放相關的膜內電荷的運動,稱為
門控電流 ,確認了離子通道的開放與膜中帶電成分運動的依從性。1976年E.內爾和B.薩克曼創立了離子單通道電流記錄技術,並迅速得到推廣套用,近年用這種技術發現了一些新型離子通道,為深入研究通道的結構和功能提供了有力的工具。
80年代初,學者們先後從細胞膜上分離和純化了一些運輸離子的功能性蛋白質,並在
人工膜 上成功地重建了通道功能,從而肯定了離子通道實體就是膜上一些特殊蛋白質分子或其複合物。近年,科學家套用基因重組技術研究
離子通道 的結構,1982和1984年,紐莫及合作者先後測定了N型Ach受體和
鈉離子通道 蛋白的胺基酸序列。
2018年2月26日報導,中國科學技術大學田長麟教授研究組與德國萊布尼茨分子藥物所Adam Lange及孫涵課題組合作,套用固體核磁共振、單通道電生理及分子動力學模擬等方法揭示了NaK離子通道的離子選擇性新機制。該研究成果已發表在《自然·通訊》上。
研究方法 離子通道結構和功能的研究需綜合套用各種技術,包括:電壓和電流鉗位技術、單通道電流記錄技術、通道蛋白分離、純化等生化技術、人工膜離子通道重建技術、通道藥物學、基因重組技術及一些物理和化學技術。
電壓鉗位技術
一般而言,膜對某種離子通透性的變化是
膜電位 和時間的函式。通過玻璃微電極與細胞膜之間形成緊密封接,利用電子學技術施加一跨膜電壓並把膜電位固定於某一數值,可以測定該膜電位條件下離子電流隨時間變化的動態過程。利用藥物或改變細胞內外的溶液成分,使其他離子通道失效,即可測定被研究的某種離子通道的功能性參量,分析離子電流的穩態和動力學與膜電位、離子濃度等之間的關係,可推斷該種通道的
電導 、活化和失活速率、
離子選擇性 等,並能測量和分析通道的
門控電流 的特性。
單通道電流記錄技術
又稱膜片鉗位技術,用特製的玻璃微吸管吸附於細胞表面,使之形成10~100GΩ的密封(giga-seal),被孤立的小膜片面積為μm2量級,內中僅有少數離子通道。然後對該膜片實行
電壓鉗 位,可測量單個離子通道開放產生的pA(10-12安培)量級的電流,這種通道開放是一種隨機過程。通過觀測單個通道開放和關閉的電流變化,可直接得到各種離子通道開放的電流
幅值 分布、開放幾率、開放壽命分布等功能參量,並分析它們與膜電位、
離子濃度 等之間的關係。還可把吸管吸附的膜片從細胞膜上分離出來,以膜的外側向外或膜的內側向外等方式進行實驗研究。這種技術對
小細胞 的電壓鉗位、改變膜內外溶液成分以及施加藥物都很方便。
通道藥物學研究
套用電壓鉗位或單通道電流記錄技術,可分別於不同時間、不同部位(膜內側或外側)施用各種濃度的藥物,研究它們對通道各種功能的影響。結合對藥物分子結構的了解,不但可以深入了解藥物和毒素對人和動物生理功能作用的機制,還可以從分子水平得到通道功能亞單位的類型和構象等信息。
通蛋離、通建和基重術
利用與通道特異結合的毒劑標記,可把通道蛋白質從膜上分離下來,經過純化,可以測定各亞單位多肽的分子量。然後,把它們加入人工膜,可重新恢復通道功能。用於確定蛋白質胺基酸序列的基因重組技術的程式是:從細胞中分離出含有與該種通道蛋白相關的mRNA,置入某種細胞(如大腸桿菌),經
逆轉錄 得到cDNA。用
限制性內切酶 將cDNA切割成特定片段,再用
核酸雜交 方法釣出特定的DNA並
克隆化 。通過測定
陽性克隆 DNA的核苷酸順序,推斷出相應的蛋白質胺基酸序列。
功能特徵 離子通道依據其活化的方式不同,可分兩類:一類是電壓活化的通道,即通道的開放受膜電位的控制,如Na+ 、Ca2+ 、Cl- 和一些類型的K+ 通道;另一類是化學物活化的通道,即靠化學物與膜上受體相互作用而活化的通道,如 Ach受體通道、胺基酸受體通道、Ca2+ 活化的K+ 通道等。
鈉通道
各種生物材料中,與電興奮相關的Na+ 通道有相似的基本特徵。通道活化時間常數小於1毫秒,失活時間常數為數毫秒,Na+ 電流的反轉電位約+55毫伏。單通道電流記錄顯示,Na+ 單通道電導為4~20pS,平均開放壽命數毫秒。
根據一些藥物和毒素對Na+ 通道功能的不同影響,可分為4種類型:
①通道阻斷劑,如河豚毒素(TTX)、
石房蛤毒素 (STX)。
③通道活化抑制劑,如一些局部麻醉劑及其衍生物。
④通道失活抑制劑,如
鏈霉蛋白酶 、N-溴乙醯胺(NBA)等。
鉀離子通道
根據功能特性的不同,K+通道可分為以下類型:①慢(延遲)K+通道(K通道),也就是H-H模型中的K+通道。單通道電流記錄顯示,單個K通道
電導 在2~20pS,通道平均開放壽命為數十毫秒。該種通道可被
四乙胺 (TEA)等
特異性 阻斷,通道對K+有高度選擇性,但R姾和NH嬃亦能通過,這種通道在神經軸突和骨骼肌細胞膜中有較高密度。②快(早期)K+通道(A通道),該種通道外向的K+流在膜
去極化 的早期就出現,表明通道的活化時間常數比慢K+通道小得多,但在-40毫伏以上該通道即關閉。
電壓鉗 位實驗表明,其巨觀電流動力學與Na+電流相似。較低濃度的4-氨基吡啶即能阻斷該通道,它也可被四乙胺阻斷。③Ca2+活化的K+通道〔K(Ca)通道〕,該種通道的開放,不但與膜電位有關,而且依賴於細胞內Ca2+的濃度,每個通道需結合兩個Ca2+才能活化。單通道電導可高達300pS,並有較長的開放壽命,這種通道與Ca2+通道協同作用,對調節細胞膜電興奮性的節律有重要意義。它可被
四乙胺 、N'-四乙酸(EGTA)、奎尼丁和Ba2+阻斷。④內向整流的K+通道,其特徵是:在膜
超極化 時通道開放與膜電位和胞外K+濃度密切相關,通道開放時產生內向K+電流,單通道電導在5~10pS範圍。
鈣離子通道
Ca
2+ 通道廣泛存在於各種生物組織的細胞膜中。巨觀的Ca2+電流動力學特徵與Na2+電流相似,但峰值小且失活過程慢,可達數十到數百毫秒。Ca
2+ 通道對Ca
2+ 、Ba
2+ 、Sr
2+ 都有高通透性,但Ni
2+ 、Cd
2+ 、Co
2+ 、Mn
2+ 等離子能有效地阻斷Ca2+通道。藥物對Ca2+通道的作用可分為:①通道阻斷或
抑制劑 ,可分為苯烷基胺類(如異博定、甲基異博定D600)、苯硫氮類、雙氫吡啶類等類型。②通道
激活劑 ,一些雙氫吡啶化合物如BayK8644等藥物可活化Ca
2+ 通道。近年,對小雞
背根神經節 細胞的研究發現有3種類型的Ca
2+ 通道:①L型,該種通道在膜電位大於-20毫伏時活化,電流失活緩慢。單通道
電導 約25pS。②T型,膜電位約-60毫伏時通道即活化,-10毫伏以上通道電流
幅值 反而下降,單通道電導約8pS。③N型,該種通道在膜電位不小於-10毫伏才能活化,但又必須
超極化 到-80毫伏以下才能克服通道的失活。電流動力學比 L型快但比T型慢,單通道電導約13pS。以上3類Ca2+通道在不同細胞膜上
選擇性 分布及密度的差別,將影響各種細胞的生理功能。Ca2+通道除了對細胞電興奮性有貢獻外,它通過調節細胞內Ca2+濃度,可進一步調節許多細胞功能。
N型乙醯膽鹼受體通道
它是由神經遞質Ach活化的正離子通道。當突觸前膜一次
量子化 釋放數千個 Ach分子,它們作用於突觸後膜上的N型受體時,受體通道開放,產生Na+和K+電流,引發突觸後膜一個
小終板電位 (mEPP)。N-AchR單通道
電導 在20~60pS範圍,平均開放壽命數毫秒,通道電流反轉電位約-10毫伏,近年發現該種通道有多種電導態(見圖)。通道的離子選擇性較差,可允許數十種無機和有機正離子通過,許多毒素和有機物能阻斷或抑制該種通道,α-銀環蛇毒(α-BGTX)是 N型Ach受體通道的特異性
阻斷劑 。
80年代以來,已發現多種由神經遞質和激素活化的受體通道,如
谷氨酸受體 通道、
多巴胺受體 通道、5-羥色胺受體通道、γ-氨基丁酸受體通道等。
其它相關 分子構象和門控動力學
離子通道研究的前沿是試圖從分子水平揭示通道蛋白的空間構象、構象變化與通道門控動力學之間的關係。
N-AchR通道
已測定了受體蛋白質分子量是250000,並測定了它的全部胺基酸序列,確證該受體通道由、α、γ和δ5個亞基組成,這4種亞基有相似的胺基酸順序,但只有α亞基上有 α-BGTX的特異結合位點。一種
構象 模型是:5個
亞基 各有若干個α螺旋跨膜排列,共同形成五瓣狀的蛋白質複合物,兩個α亞基間是親水的離子通道,通道開口約25埃,中間是6~7埃的狹窄孔道,其中排列有負電性
胺基酸殘基 側鏈。當兩個 Ach分子分別結合於兩個α亞基特
定位點 後,引起局部構象變化,使通道開放。
鈉通道
從電鰻電板分離的鈉通道蛋白質分子量是208321,是由1820個胺基酸組成的多肽序列,可分為4個相似的區段,每個區段中分別有較集中的正電性和負電性的胺基酸序列節段。多種鈉通道構象模型的共同特徵是:由多個α螺旋跨膜排列組成通道,通道內側應富含
極性 的
胺基酸殘基 側鏈,每個通道的控制部分由離子
選擇性 濾器、活化閘門和失活閘門3部分組成,其實體是胺基酸側鏈的極性基團。膜電位變化時,電場誘導極性基團運動,使通道局部構象發生變化,導致通道的開放、失活或關閉,並產生
門控電流 。關於關閉、活化和失活3種狀態之間的轉化,有兩種觀點:一種認為通道從關閉態必須經活化態才能轉化為失活態(
偶聯 方式),另一種認為從關閉態可以直接轉化為失活態(非偶聯方式),目前非偶聯方式得到較多的實驗事實支持。
離子通道特性
1、選擇性:指一種通道優先讓某種離子通過,而另一些離子則不容易通過該種通道的特性。例如鈉通道開放時,鈉離子可通過,而
鉀離子 則不能通過。
2、開關性:離子通道存在兩種狀態,即開放和關閉狀態。多數情況時,離子通道是關閉的,只在一定的條件下開放。通道由關閉狀態轉為開放的過程稱為激活,由開放轉為關閉狀態的過程稱為失活。通道的開放與激活過程有一定的速率,通常很快,以毫秒(ms) 計算。
離子通道分類
離子通道的開放和關閉,稱為門控。根據門控機制的不同,將離子通道分為三大類:
⑴電壓門控性,又稱電壓依賴性或電壓敏感性離子通道:因膜電位變化而開啟和關閉,以最容易通過的離子命名,如鉀、鈉、鈣、氯通道四種主要類型,各型又分若干亞型。
⑵
配體 門控性,又稱化學門控性離子通道。由遞質與通道蛋白質
受體分子 上的結合位點結合而開啟,以遞質受體命名,如乙醯膽鹼受體通道、
谷氨酸受體 通道、
門冬氨酸 受體通道等非選擇性
陽離子 通道一系由配體作用於相應受體而開放,同時允許鈉、鈣 或鉀通過。
⑶機械門控性,又稱機械敏感性離子通道:是一類感受細胞膜
表面應力 變化,實現胞外機械信號向胞內轉導的通道,根據
通透性 分為離子選擇性和非離子選擇性通道,根據功能作用分為張力激活型和張力失活型離子通道。
此外,還有細胞器離子通道,如廣泛分布於哺乳動物細胞
線粒體外膜 上的電壓依賴性陰離子通道,位於細胞器
肌質網 或
內質網 ,膜上的受體通道、受體通道。
電壓門控鈣通道(VGC) 分為L型(Long-lasting)、N型(No-Long lasting,non-tsansient)、T型(Transient)和P/ Q 四個亞型。
L 型通道:電導較大、失活慢、持續時間長、需要強的
去極化 才能激活,在心血管、內分泌和神經等多種組織中表達,參與電- 收縮耦聯和調控代謝。
T型通道:
電導 小、失活快、弱的去極化電流即能激活,它主要分布在心臟和血管平滑肌,觸發起搏電活動。
N 型通道:失活較快、需強的去極化電流激活,目前僅在神經組織中發現,主要觸發交感神經遞質的釋放。
P/ Q 通道:具有相同的α1
亞單位 (α1A) 統稱為P/ Q 型
鈣通道 。P/ Q 型鈣通道在神經遞質釋放過程中有重要作用。
鉀通道:一種廣泛存在於細胞膜上的鉀離子選擇性通過的蛋白複合體,在結構和功能上形成通道的一大家庭。鉀離子通道一般可分為四個基本類型:電壓門控鉀通道(Voltage - gated K+ Channels,KV) 、鈣激活鉀通道(Calcium - activated K+ Channels,KCa) 、三磷酸腺苷敏感性鉀通道(ATP – Sensitive K+ Channels,KATP) .
電壓門控鉀通道又分為:內向整流鉀離子通道(Inward rectifier K+ Channds,Kir)、延遲外向整流鉀通道、瞬時外向鉀通道。
離子通道生理功能
⑴提高細胞內鈣濃度,從而觸發肌肉收縮、細胞興奮、腺體分泌、鈣依賴性離子通道開放和關閉、蛋白激酶的激活和基因表達的調節等一系列生理效應。
⑶調節血管平滑肌舒縮活動,其中有鉀、鈣、氯通道和某些非選擇性
陽離子 通道與參與。
⑷參與突觸傳遞。
⑸維持細胞正常體積,在高滲環境中,離子通道和轉運系統激活使鈉、氯和水分進入細胞內而調節細胞體積增大。在低滲環境中,鈉、氯和水分流出細胞而調節細胞體積減少。
離子通道病
編碼離子通道亞單位的基因發生突變/ 表達異常或體內出現針對通道的病理性內源性物質時,使通道的功能出現不同程度的削弱或增強,從而導致機體整體生理功能的紊亂,出現某些先天性和後天獲得性疾病。
可分為先天性離子通道病(geneticchannelopathy) 和獲得性離子通道病(acquiredchannelopathy),其中後者既可由
基因表達 異常引起,又可由出現抗體等物質導致。
根據通道的類型可分為電壓門控性離子通道病(voltage-gated channelopat hy) 和配體門控性離子通道(ligandgatedchannelopathy) 等,後者也是“受體病(receptor diseases) ”的一種。
根據離子通道功能的改變不同可分為:功能增益性離子通道病和功能削弱性離子通道病等;
根據離子通道病變累及的系統可分為:神經肌肉系統離子通道病(如鉀通道突變所致的BFNC(benign familial neonatal convulsions)等)、心血管系統離子通道病(如長QT綜合徵)、泌尿系統離子通道病(如Bartter綜合徵)、呼吸系統離子通道病(如肺囊性纖維化等) 等。
1、鉀通道病:鉀離子通道在所有可
興奮性 和非興奮性細胞的重要信號傳導過程中具有重要作用,其家族成員在調節神經遞質釋放、心率、胰島素分泌、神經細胞分泌、上皮細胞電傳導、骨骼肌收縮、細胞容積等方 面發揮重要作用。已經發現的鉀通道病有良性家族性新生兒驚厥、1型發作性共濟失調、陣發性舞蹈手足徐動症伴發作性共濟失調、癲癇、長QT綜合徵等。
2、
鈉通道 病:鈉離子通道在大多數興奮細胞
動作電位 的起始階段起重要作用,已經發現的鈉通道病有高鉀型周期性麻痹、正常血鉀型周期性麻痹、先天性肌無力等。
3、
鈣通道 病鈣離子通道廣泛存在於機體的不同類型組織細胞中,參與神經、肌肉、分泌、生殖等系統的生理過程。已經發現的鈣通道病有家族性偏癱型偏頭痛、低鉀型周期性癱瘓、共濟失調、肌無力綜合徵等。
4、氯通道病:氯離子通道廣泛分布於機體的
興奮性 細胞和非興奮性細胞膜及
溶酶體 、
線粒體 、
內質網 等細胞器的質膜,在細胞興奮性調節、跨上皮
物質轉運 、細胞容積調節和細胞器酸化等方面具有重要作用。已經發現的氯通道病有先天性肌強直、
隱性遺傳 全身性肌強直、囊性纖維化病、遺傳性腎結石病。
疾病離子通道改變
病變中的離子通道改變是指由於某一疾病或藥物引起某一種或幾種離子通道的數目、功能甚至結構變化。
如老年性痴呆症(AD):大量的研究發現患者體內的一些內源性致病物質如β澱粉樣蛋白、β澱粉樣蛋白前體、早老素蛋白 與鉀通道、
鈣通道 功能異常密切相關,可能通過影響鉀通道、鈣通道的本身結構和或調節過程等,參與患者早期記憶損失、認知功能下降等症狀的出現。
如腦缺血:缺血後能量代謝紊亂,細胞內ATP合成下降,突觸間隙的
谷氨酸 劇增,谷氨酸作用NMDA
受體 ,引起受體依賴性鈣通道開放,鈣內流增加,導致神經細胞內鈣超載谷氨酸還可經非NMDA途徑使鈉通道開放,引起鈉內流增加,隨即引起氯和水內流,導致神經細胞急性滲透性腫脹。
作用於鈉通道的藥物
絕大多數鈉通道為電壓門控性通道,主要是維持細胞膜的興奮性和傳導性。
分布密度不等,每平方微米幾百個到幾千個。
重要特性:對鈉高度選擇性、電壓依賴性、激活和失活速度快。
有激活閘門、失活閘門、電壓感受器
藥物有3類:
促進失活的藥物:局麻藥、聚L-精氨酸等
阻滯或促進鈉通道失活的藥物抑制快鈉內流,促進激活或抑制失活的藥物增大鈉內向電流。
作用於鉀通道的藥物
鉀通道分布廣泛,有數十種類型;
⑴瞬時外向鉀通道:廣泛存在於心肌細胞
生理特性:電壓依賴性、時間依賴性、頻率依賴性、失活。表現為瞬時外向電流(Ito),隨後關閉。Ito是參與心肌復極主要離子流。
⑵延遲外向整流鉀通道:延遲外向整流鉀通道電流(Ik)可分為快激活整流鉀電流(Ikr)和慢激活整流鉀電流(Iks)
生理特性:
延遲整流 性、時間依賴性、電壓依賴性。參與心肌動作到位
復極化過程 ,是抗心律失常藥物作用重要
分子靶標 ,如Ⅲ類抗心律失常藥胺碘酮等
⑶內向整流鉀通道(Kir):分布於心肌、骨骼肌、平滑肌、內分泌細胞等
生理功能:維持細胞
靜息電位 、調節血管平滑肌舒縮等。
四乙胺 、Zn
2+ 、Cd
2+ 、Cs
+ 、Ba
2+ 等離子為非特異性阻斷劑;苯吡喃的
衍生物 是特異性阻斷劑。
⑷鈣激活鉀通道(Kca)
廣泛分布於除心肌以外的各組織細胞,是一個大家族,分3個亞類:大電導型(BKca)、中電導型(IKca)和小電導型(SKca)。BKca調節血管平滑肌起重要作用,其阻斷劑有:iberiotoxin,charybdotoxin。
⑸ATP敏感性鉀通道(KATP):分布於胰腺細胞、神經元、平滑肌等
KATP可能抗缺血損傷的藥物作用靶標。
作用於鈣通道的藥物
鈣通道阻滯劑和鈣通道激活劑。
⑴鈣通道阻滯劑
發展極其迅速,有數十種,主要用於心血管病治療。國際藥理學會分類:
一類:選擇性作用於L-型鈣通道明確位點的藥物,根據
化學結構 又分為:Ia類:二氫吡啶類如硝苯地平;Ib類:地爾硫卓類如地爾硫卓;Ic類:苯烷胺類如維拉帕米;Id類如粉防己鹼等。
二類:選擇性作用於其它電壓門控
鈣通道 的藥物;如作用於T通道藥物苯妥英、右美沙芬等;作用於N通道的
芋螺毒素 ,作用於P通道的蜘蛛毒素
⑵鈣通道激活劑
增加鈣內流、促進遞質和激素分泌,引起心肌和平滑肌收縮。主要作為工具藥。
作用於氯通道的藥物
電壓依賴性氯通道、容積激活性氯通道、鈣激活性氯通道、配體激活性氯通道等。
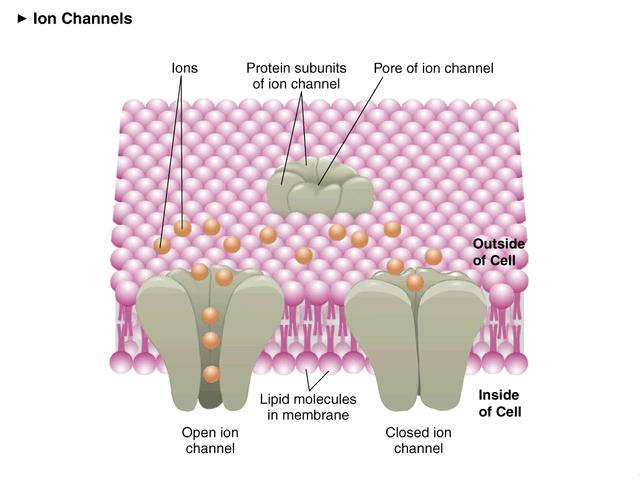 生物膜離子通道
生物膜離子通道
 生物膜離子通道
生物膜離子通道