溶酶體的酶,概述,特點,分類概述,傳統分類,新提法,按功能階段分類,初級溶酶體,次級溶酶體,殘體,功能作用,形成過程,溶酶體與疾病,矽肺,肺結核,各類溶酶體貯積症,遺傳性疾病,類風濕關節炎,休克,腫瘤,
溶酶體的酶
概述
在大鼠肝臟中,從比
線粒體分區稍輕的地方得到含有水解酶的顆粒分區,並以可進行水解(lyso)的小體(some)這個意義而命名為溶解體(lysosome;lss)。溶酶體中的酶是酸性磷酸酶、
核糖核酸酶、
脫氧核糖核酸酶、
組織蛋白酶、芳基硫酸醋酶、B-葡糖苷酸酶、乙醯基轉移酶等,是在酸性區域具有最適pH的水解酶組。據電子顯微鏡觀察,溶酶體是由6~8納米厚的單層膜所圍著的直徑為0.4微米至數微米的顆粒或小泡。由於其形態極其多樣化,所以把對
酸性磷酸酶活性為陽性的物質鑑定為溶酶體。
特點
溶酶體的酶有3個特點:
(1)溶酶體表面高度糖基化,有助於保護自身不被酶水解。膜蛋白多為
糖蛋白,溶酶體膜內表面帶負電荷,有助於溶酶體中的酶保持游離狀態。這對行使正常功能和防止細胞自身被消化有著重要意義;
(2)所有水解酶在pH值=5左右時活性最佳,但其周圍胞質中pH值=7.2。溶酶體膜內含有一種特殊的轉運蛋白,可以利用ATP水解的能量將胞質中的H+(氫離子)泵入溶酶體,以維持其pH值=5;
(3)只有當被水解的物質進入溶酶體內時,溶酶體內的酶類才行使其分解作用。一旦溶酶體膜破損,水解酶逸出,將導致細胞自溶。
分類概述
傳統分類
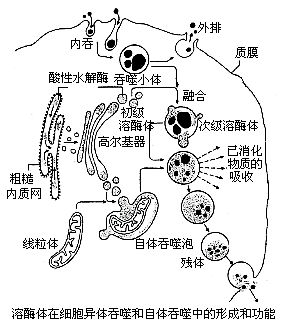
根據內含物和形成階段的不同,溶酶體可分為兩大類,具有均質基質的顆粒狀溶酶體稱為初級溶酶體(primary lysosome),含有複雜的髓磷脂樣結構的液泡狀溶酶體稱為次級溶酶體(secondary lysosome)。屬於初級溶酶體的溶酶體,具有肝實質細胞(
肝細胞)的高電子密度的顆粒等。這種溶酶體雖含有水解酶,但是它是未進行消化作用的溶酶體。次級溶酶體(消化泡)是由初級溶酶體與細胞
吞噬作用所產生的吞噬體相互融合而成的,並且是已供給水解酶的溶酶體。在次級溶酶體中含有攝食的物質,並對其進行消化。消化後所殘留的未消化物稱為殘餘小體。一般認為,殘餘小體在變形蟲等細胞中被排出細胞之外,但在其他細胞中,則長期留在細胞中,而成為細胞衰老的原因。
新提法
關於溶酶體的類型和命名,有新提法。有研究資料表明,根據溶酶體的形成過程和功能,把溶酶體命名為前溶酶體(endolysosome)和溶酶體。晚期胞內體與脫包被的含有溶酶體酶的轉運小泡融合成前溶酶體,它從高爾基體或細胞膜上的轉運泡(如果是從細胞膜上通過胞飲作用在格線蛋白介導下回收的溶酶體酶則在脫去包被後形成胞內體)接受了新合成的水解酶和溶酶體膜蛋白,在質子泵的作用下,pH維持在低水平。隨後已經
糖基化且
磷酸化的溶酶體酶與膜上的M6P受體分離。接著,M6P與溶酶體酶分離,溶酶體酶去磷酸化。pH再進一步降低,即成為溶酶體。而M6P受體則可以進一步回收至高爾基體TGN或細胞膜上。
吞噬體與前溶酶體或溶酶體融合成吞噬溶酶體;自噬體與前溶酶體或溶酶體融合形成自噬溶酶體。吞噬溶酶體和自噬溶酶體將物質水解成小分子物質,被細胞吸收,還殘留一些不被消化和吸收的物質稱為殘質體。經出胞作用排出細胞,但大部分殘質體留在細胞內,如脂褐色素、老年斑即是這種色素的沉積。
按功能階段分類
1955年首次發現溶酶體(lysosome)。它是單層膜圍繞、內含多種酸性水解酶類的囊泡狀細胞器,其主要功能是進行細胞內消化。
具有異質性,形態大小及內含的水解酶種類都可能有很大的不同,
標誌酶為酸性磷酸酶。根據完成其生理功能的不同階段可分為初級溶酶體(
primarylysosome),次級溶酶體(secondary lysosome)和
殘體(residual body)。
初級溶酶體
直徑約0.2~0.5um膜厚7.5nm,內含物均一,無明顯顆粒,是
高爾基體分泌形成的。含有多種水解酶,但沒有活性,只有當溶酶體破裂,或其它物質進入,才有酶活性。其水解酶包括蛋白酶,核酸酶、脂酶、磷酸酶、硫酸酯酶、磷脂酶類,已知60餘種,這些酶均屬於酸性水解酶,反應的最適PH值為5左右,溶酶體膜雖然與質膜厚度相近,但成分不同,主要區別是:①膜有
質子泵,將H+泵入溶酶體,使其PH值降低。②膜蛋白高度糖基化,可能有利於防止自身膜蛋白降解。
次級溶酶體
這些都是消化泡,正在進行或完成消化作用的溶酶體,內含水解酶和相應的底物,可分為異噬溶酶體(phagolysosome)和自噬溶酶體(autophagolysosome),前者消化的物質來自外源,後者消化的物質來自細胞本身的各種組分。
根據溶酶體作用物的來源,將次級溶酶體分為:
(1)異生性溶酶體(het- erolysosome),系指不能透過
質膜的大分子溶液或病毒、細菌等,前者通過胞飲作用(其中也包括受體介導的內吞作用)形成的胞飲泡(或胞內體),後者通過吞噬作用形成的吞噬泡,分別與初級溶酶體(或內溶酶體)融合後形成次級溶酶體(或溶酶體)。
(2)自生性溶酶體(autolysosome)或自噬溶酶體(autophagolyso- some),系指包圍了部分被損傷或衰老細胞器(線粒體、內質網碎片等)的自體吞噬體(autophagosome)與初級溶酶體(或內溶酶體)融合後形成的次級溶酶體。其消化的物質是內源性的。內含不能被消化的殘留物質的次級溶酶體被稱為殘留小體。殘留物質有的可排出,有的長期貯留在細胞內不被排出。
殘體
殘體又稱後溶酶體(post-lysosome)已失去酶活性,僅留未消化的殘渣故名,殘體可通過外排作用排出細胞,也可能留在細胞內逐年增多,如肝細胞中的
脂褐質。
功能作用
溶酶體的功能有二:一是與
食物泡融合,將細胞吞噬進的食物或致病菌等大顆粒物質消化成
生物大分子,殘渣通過胞吐作用排出細胞;二是在
細胞分化過程中,某些衰老的細胞器和生物大分子等陷入溶酶體內並被消化掉,這是機體自身更新組織的需要。
溶酶體的主要作用是消化作用,是細胞內的消化器官,細胞自溶,防禦以及對某些物質的利用均與溶酶體的消化作用有關。
細胞內消化:對高等動物而言細胞的營養物質主要來源於血液中的大分子物質,而一些大分子物質通過內吞作用進入細胞,如內吞低密脂蛋白獲得膽固醇,對一些單細胞真核生物,溶酶體的消化作用就更為重要了。
細胞凋亡:個體發生過程中往往涉及組織或器官的改造或重建,如昆蟲和蛙類的變態發育等等。這一過程是在基因控制下實現的,稱為程式性細胞死亡,注定要消除的細胞以出芽的形式形成凋亡小體,被巨噬細胞吞噬並消化。
自體吞噬:清除細胞中無用的生物大分子,衰老的細胞器等,如許多生物大分子的半衰期只有幾小時至幾天,肝細胞中線粒體的平均壽命約10天左右。
防禦作用:如吞噬細胞可吞入病原體,在溶酶體中將病原體殺死和降解。
形成
精子的頂體:
頂體相當於一個化學鑽,可溶穿
卵子的皮層,使精子進入卵子。
選擇性地包裝成初級溶酶體。
所有白細胞均含有溶酶體性質的顆粒,能消滅入侵的微生物。然而,也有一些病源菌(如麻風桿菌、結核桿菌等)能耐受溶酶體酶的作用,因而能在巨噬細胞記憶體活。溶酶體在病理過程中也有重要意義。由於肺巨噬細胞吞噬吸入的矽或石棉粉塵,引起溶酶體破裂和水解酶的釋放,刺激結締組織纖維的增加,導致矽肺的發生。組織缺氧(如心肌梗死)也可造成溶酶體的急性釋放,使血液中有關酶的濃度迅速增高。
形成過程
初級溶酶體是在高爾基體的trans面以出芽的形式形成的,其形成過程如下:
內質網上
核糖體合成溶酶體蛋白→進入內質網腔進行N-連線的糖基化修飾,溶酶體酶蛋白先帶上3個葡萄糖、9個甘露糖和2個N-乙醯葡萄糖胺,後切除三分子葡萄糖和一分子甘露糖→進入高爾基體Cis面膜囊→N-乙醯葡糖胺磷酸轉移酶識別溶酶體水解酶的
信號斑→將N-乙醯葡糖胺磷酸轉移在1~2個甘露糖殘基上→在中間膜囊由N-乙醯葡萄糖苷酶切去N-乙醯葡糖胺形成M6P配體→與trans膜囊上的受體結合→選擇性地包裝成初級溶酶體。
溶酶體與疾病
矽肺
二氧化矽塵粒(矽[xī]塵)吸入肺泡後被巨噬細胞吞噬,含有矽塵的吞噬小體與溶酶體合併成為次級溶酶體。二氧化矽的羥基與溶酶體膜的磷脂或蛋白形成氫鍵,導致
吞噬細胞溶酶體崩解,細胞本身也被破壞,矽塵釋出,後又被其他巨噬細胞吞噬,如此反覆進行。受損或已破壞的巨噬細胞釋放“致纖維化因子”,並激活成纖維細胞,導致膠原纖維沉積,肺組織纖維化。
肺結核
結核桿菌不產生內、外毒素,也無莢膜和侵襲性酶。但是菌體成分硫酸腦苷脂能抵抗胞內的溶菌殺傷作用,使結核桿菌在肺泡內大量生長繁殖,導致巨噬細胞裂解,釋放出的結核桿菌再被吞噬而重複上述過程,最終引起肺組織鈣化和纖維化。
各類溶酶體貯積症
溶酶體
貯積症(Lysosome Storage Diseases 簡稱:LSDs)是由於遺傳缺陷引起的,由於溶酶體的酶發生變異,功能喪失,導致底物在溶酶體中大量貯積,進而影響細胞功能,常見的貯積症主要有以下幾類:
台-薩氏綜合徵(Tay-Sachs diesease):要叫
黑蒙性家族痴呆症,溶酶體缺少氨基已糖酯酶A(β-N-hexosaminidase),導致神經節甘脂GM2積累(圖6-30),影響細胞功能,造成精神痴呆,2~6歲死亡。患者表現為漸進性失明、病呆和癱瘓,該病主要出現在猶太人群中。
II型糖原累積病(Pompe病或稱龐貝氏病):溶酶體缺乏α-1,4-葡萄糖苷酶,糖原在溶酶體中積累,導致心、肝、舌腫大和骨骼肌無力。屬常染色體缺陷性遺傳病,患者多為小孩,常在兩周歲以前死亡。
戈謝病(Gaucher病):又稱腦苷脂沉積病,是巨噬細胞和腦神經細胞的溶酶體缺乏β- 葡萄糖苷酶造成的。大量的葡萄糖腦苷脂沉積在這些細胞溶酶體內,巨噬細胞變成戈謝細胞,患者的肝、脾、淋巴結等腫大,中樞神經系統發生退行性變化,常在1 歲內死亡。
細胞內含物病(inclusion-cell disease,I-cell disease):一種更嚴重的貯積症,是N-乙醯葡糖胺磷酸轉移酶單基因突變引起的。由於基因突變,高爾基體中加工的溶酶體前酶上不能形成M6P分選信號,酶被運出細胞(default pathway)。這類病人成纖維細胞的溶酶體中沒有水解酶,導致底物在溶酶體中大量貯積,形成所謂的“包涵體(inclusion)”。另外這類病人肝細胞中有正常的溶酶體,說明溶酶體形成還具有M6P之外的途徑。
遺傳性疾病
溶酶體中酸性水解酶的合成,象其它蛋白質的生物合成過程一樣,是由基因決定的,當基因突變引起酶蛋白合成障阻時,可造成溶酶體酶缺乏。機體由於基因缺陷,可使溶酶體中缺少某種水解酶,致使相應作用物不能降解而積蓄在溶酶體中,造成細胞代謝障阻,形成溶酶體貯積病。其主要的病理表現為有關臟器(肝、腎、心肌、骨骼肌)中溶酶體過載,即細胞攝入過多或不能消化的物質,或因溶酶體酶活性降低,以及機體的年齡增長,從而在細胞內出現大量溶酶體蓄積造成過載。目前已知這類疾病達40餘種,國內可檢測的有30多種(見詞條:溶酶體貯積症)。其中糖原貯積病Ⅱ型是最早被發現的。由於在肝細胞常染色體上的一個基因缺陷,使溶酶體內缺乏α-葡萄糖苷酶,導致糖原無法降解為葡萄糖,而造成糖原在肝臟和肌肉大量積蓄。此病多發生於嬰兒。臨床表現為肌無力,心臟增大,進行性心力衰竭,多於兩周歲以前死亡,故此病又稱為心臟型糖原沉著病。
類風濕關節炎
對
類風濕關節炎的病因還不清楚,但此病所表現出來的關節骨膜組織的炎症變化以及關節軟骨細胞的腐蝕,被認為是細胞內的溶酶體的局部釋放所致。其原因可能是由於某種類風濕因子,如抗IgG,被巨噬細胞、中性粒細胞等吞噬,促使溶酶體酶外逸。而其中的一些酶,如膠原酶,能腐蝕軟骨,產生關節的局部損害,而軟骨消化的代謝產物,如硫酸軟骨素,又能促使激肽的產生而參與關節的炎症反應。
休克
在
休克過程中,機體微循環發生紊亂,組織缺血、缺氧,影響了供能系統,使膜不穩定,引起溶酶體酶的外漏,造成細胞與機體的損傷。休克時機體細胞內溶酶體增多,體積增大,吞噬體顯著增加。溶酶體內的酶向組織內外釋放,多在肝和腸系膜等處,引起細胞和組織自溶。因此,在休克時,測定淋巴液和血液中溶酶體酶的含量高低,可作為細胞損傷輕重度的定量指標。通常以酸性磷酸酶、β-葡萄糖醛酸酶與組織蛋白酶為指標。關於休克時溶酶體釋放的機理,有人提出是由於pH降低和三羧酸循環受阻。休克時缺血缺氧,引起細胞pH值的下降(約pH5),酸性水解酶活化,水解溶酶體膜,最終導致溶酶體膜裂解,溶酶體釋放,使細胞、組織自溶。
腫瘤
溶酶體與腫瘤的關係日益引起人們的關注,一般有以下幾種觀點:
(1)致癌物質引起細胞分裂調節機能的障阻及染色體畸變,可能與溶酶體釋放水解酶的作用有關;
(2)某些影響溶酶體膜
通透性的物質,如巴豆油,某些去垢劑、高壓氧等,是促進致癌作用的輔助因子,也能引發細胞的異常分裂;
(3)在核膜殘缺的情況下,核膜對核的保護喪失,溶酶體可以溶解染色質,而引起細胞突變;
(4)溶酶體代謝過程中的某些產物是腫瘤細胞增殖的物質基礎;
(5)致癌物質進入細胞,在與染色體整合之前,總是先貯存在溶酶體中,這已為放射自顯影所證實。
總之,溶酶體與腫瘤發生是否有直接關係,尚待進一步探索。