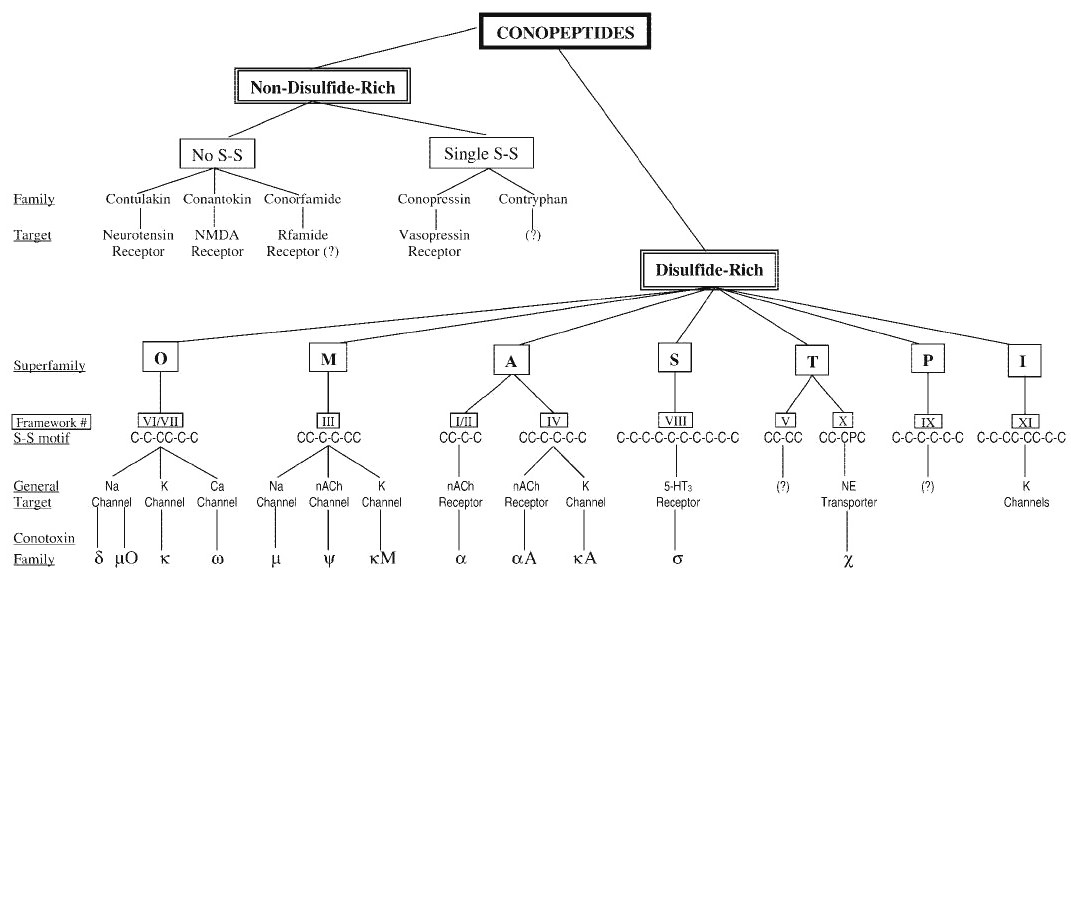
芋螺簡介,超家族毒素,A-超家族,I-超家族,生化性質,分類,命名,空間結構,毒素製備,人工採集,基因合成,人工合成,合成的新技術,線性肽合成,分子生物學特徵,編碼,翻譯,殘基的影響,毒理學,毒性,芋螺毒活性肽,協同作用,離子通道,藥理學,作用機制,抗癲癇,抗慢性疼痛,抗腦缺血損傷,抗藥物成癮,其他,
芋螺簡介 芋螺是最古老的
海洋生物 物種之一,最早出現在5500萬年前,屬於
腹足綱 芋螺科(Conidae),與錐螺科(Turridae)、筍螺科(Terebridae)同屬於芋螺首科(Conoidea),並且同以具有毒液裝置為其特徵,但是芋螺科生物毒性最大,種類最多。它們的殼很精巧,花紋美麗且變化多樣。棲息在熱帶海洋的淺海水域,因外形呈圓錐形或芋頭狀而得名。芋螺具有強大的自然進化能力,單一種屬中包括有數百種物種的情況在各種生物中極為罕見,其適應新的棲息域的生存能力極強。快速進化的能力使芋螺成為海洋無脊椎動物中進化最成功的生物之一。全球的芋螺大約有500種,可能是軟體動物最大的一個種屬。遍布世界各暖海區,中國有芋螺100餘種,主要分布在西沙群島、海南島及台灣海域。僅少數分布到
海南島 北部以北的廣西和廣東大陸沿岸,個別延伸到東海。
代表性芋螺圖冊參考資料。
芋螺口腔解剖圖 芋螺食物種類很廣,包括多毛環節動物蠕蟲,頭足類動物,其他腹足動物,雙殼類、魚和甲殼綱動物。根據其捕食習性分為食魚芋螺、食螺芋螺、食蟲芋螺。其中食蟲性芋螺最為常見,而食魚芋螺的毒性最大。捕食時,它具有兩種捕獵方式,一種是將毒液釋放到周圍海水中,較為常見的第二種,迅速伸出形似魚叉般的牙齒刺入獵物體內,牙齒上具有毒素。它們會向獵物投射接連毒腺管和毒囊的針狀齒舌,並注射毒液。獵物一旦被擊中,就立刻麻痹,成為芋螺的食物。芋螺毒液是捕食與防禦作用的主要武器,毒液的毒性很強,人被刺傷時亦常導致嚴重傷害,甚至死亡。300年前,就有芋螺毒死采螺人的記錄。
芋螺毒腺 芋螺捕食過程 超家族毒素 根據芋螺毒素基因及其前體蛋白信號肽的保守性,可將芋螺毒素分為A、O、T、M、P、I等多個超家族。α、αA、κA屬於A-
超家族 ,ω、δ、κ、μO屬於O-超家族,μ、ψ、ΚM屬於M-超家族。O-超家族芋螺毒素(半胱氨酸模式C-C-CC-C-C)主要作用於電壓門控離子通道(又稱電壓敏感性通道),包括Ca2+離子通道、Na+離子通道和K+離子通道等。作用於Ca2+離子通道的只有O-超家族的ω-芋螺毒素。在此基礎上,根據每個成員保守的半胱氨酸骨架,結合其藥理學活性,將之進一步分為若干個家族,按其作用靶位的不同又可將其分為α、αΑ、δ、ε、γ、κ、λ、λ/χ、μ、μO、ρ、σ、ω、ψ等若干個家族。例如:O-超家族,包括ω-、μO-、δ-和κ-芋螺毒素;T-超家族,包括τ-和χ-芋螺毒素;A-超家族,包括α-、αA-和κA-芋螺毒素等。另外,還有一類不含二硫鍵或者僅一對二硫鍵的芋螺肽(conopeptide),由於數量少且種屬的分布相對稀少,通常直接在其名稱後面直接加一個或兩個字母來表明其種屬來源,如contryphan-R,conantokin-G等。而δ-、μ-、μO-芋螺毒素作用於不同亞型的鈉通道,分別屬於O、M超家族,統稱為鈉通道芋螺毒素。δ-芋螺毒素延緩鈉流的鈍化速度,延長動作電位的持續時間。μ-芋螺毒素分為作用於河豚毒素敏感型(TTX-S)與不敏感型(TTX-R)兩類,尤其是TTX-R型μ-芋螺毒素,序列短,活性高,選擇性強,已證實具有顯著的鎮痛效果。
A-超家族 A-超家族芋螺毒素主要包括α-、αA-和κA-芋螺毒素,通常由10~30個胺基酸組成,含有兩對或三對二硫鍵,且含有兩對二硫鍵的α-家族芋螺毒素都是按照1-3,2-4的配對方式形成loop框架的。因為只有這種配對方式才能夠使多肽分子骨架形成“ω”形的穩定的二級結構,才是多肽毒素分子熱力學最穩定的構象。三個家族中,其中兩個(α-、αA-芋螺毒素)可以選擇性作用於nAChR,作為nAChR受體的競爭性拮抗劑;而κA-芋螺毒素則主要作為阻斷劑作用於電壓敏感型鉀離子通道。
A-超家族芋螺毒素的序列分析 A-超家族芋螺毒素的cDNA序列分析發現,它們的信號肽序列具有很高的同源性,而前體肽序列在同一家族中也具有很高的保守性,成熟肽區則顯示超變異性,但是各家族的二硫鍵骨架結構仍然相對保守。但就整個A-超家族芋螺毒素來說,它不像其他超家族芋螺毒素具有完全相同的二硫鍵骨架結構,在其三個家族中,α-芋螺毒素具有CC-C-C骨架結構,而αA-和κA-芋螺毒素具有完全不同的二硫鍵骨架結構CC-C-C-C-C,這些結構上的差異也直接導致了他們在生理功能上也有明顯的分化和不同。
α-芋螺毒素是A-超家族芋螺毒素中分布最廣、
豐度 最高的家族,它們是一些12~30AA的小肽,通常含兩個二硫鍵,有20種α-芋螺毒素的一級結構得到了確證,分別來自不同的芋螺種。α-芋螺毒素是神經或肌肉乙醯膽鹼受體的抑制劑。而一種芋螺中同時可能含有6種以上的α-芋螺毒素,其靶位分子均為nAChR受體。已知不同生物物種或同一種物種體內均存在多種nAChR受體亞型,某些生物體內nAChR受體亞型可達16種之多。為了適應此種生態環境,α-芋螺毒素的分子結構不斷進化,其二硫鍵間的loop環框架與胺基酸組成發生變異。單個胺基酸取代即可提高α-芋螺毒素對某一nAChR受體亞型的選擇性100倍以上。多樣性的α-芋螺毒素可以顯著提高芋螺捕食不同生物的能力。
對α-EI的NMR結構研究表明,儘管α-EI的結構骨架與其他已知的α4/7芋螺毒素比較吻合,但是其表面電荷分布和部分表面基團位置與α-GI十分相似,也許正是這種分布造成了其對肌肉型nAChR的作用。由此推測毒素對受體亞型的選擇性也受到毒素表面電荷和基團的影響。
A-超家族芋螺毒素能選擇性阻斷nAChRs的某種亞型,使它們可作為鑑定nAChRs及其亞基的有效工具。如:α-CTxMI能特異性結合肌肉型nAChRs的α1δ亞基,而α-CTxMII選擇性作用於神經型nAChRs的α3β2亞基。在藥理學方面,A-超家族還作為鎮疼藥物已進入臨床研究,Livett等發現的芋螺毒素ACV1具有比嗎啡和Ziconotide(一種由ω-CTxMVIIA開發的鎮痛藥物)藥效更強和持續時間更長的鎮痛效果。它屬於α-CTx家族,可能是通過阻斷外周初級傳入神經元的nAChRs而發揮止痛作用,其給藥方便,可肌肉注射或皮下注射,同時也無嗎啡的成癮性和Ziconotide引起的一些副反應(如便秘、呼吸抑制等),極有望開發成為新型高效止痛藥物。同時也有望開發成用於治療焦慮症、帕金森氏病、肌肉緊張和高血壓等病症的藥物。A-超家族芋螺毒素在探討毒理藥理機制、疾病病因和建立新藥物靶位方面均可發揮不可替代的特殊作用。如κA-芋螺毒素對鉀離子通道作用位點的闡明對研究治療心血管系統疾病可能提供新的途徑。Codignola等研究表明,α-CTx能結合併阻斷小細胞肺癌表面相關的nAChR受體,在小細胞肺癌的診斷和治療中有潛在價值,這將是CTx的又一個研究領域。
I-超家族芋螺毒素的前體序列 I-超家族 已發現了幾十個I-超家族芋螺毒素(I-CTX),該家族毒素比一般的芋螺毒素要大,並且成熟肽超變異。I-超家族芋螺毒素通常由33~46個胺基酸組成,含有4對二硫鍵。分子生物學研究發現,每個芋螺毒素均有單一的mRNA編碼,原始翻譯產物是它們的蛋白前體。前體通常由N-端的信號肽,中間的Pro區和C-端的成熟肽組成。Buczek等對I-超家族芋螺毒素的cDNA序列分析發現其家族成員之間的信號肽序列同源性很低,按信號肽序列可將之分為I1和I2兩組。第1組I1-超家族芋螺毒素可視有無翻譯後修飾分為A、B兩類,其中A類芋螺毒素的C-末端倒數第3個胺基酸一般為Phe、Leu或Met,都是D型
胺基酸 ,B類芋螺毒素的信號肽和pro區與A類的較為相似,但其成熟肽的長度比A類的短,而且沒有翻譯後修飾。第2組I2-超家族芋螺毒素沒有pro區,而在其前體的C-端有一段約6~13個胺基酸的序列。
生化性質 分類 根據芋螺毒素作用於生物體內的不同靶位可分為3類:(1)作用於電壓門控離子通道的CTX,電壓門控離子通道又稱電壓敏感性通道,常以通透離子(如Na+,K+,Ca2+等)命名。(2)作用於配體門控離子通道的CTX,包括菸鹼受體、5-HT3受體、NMDA受體。配體門控通道又稱化學門控通道或遞質依賴性通道,後者按相應的受體命名。(3)作用於其他受體的CTX,CTX除了作用於離子通道以外,還有以G-蛋白為靶標的,如:芋螺加壓素和芋螺惰性素,以及2種磷脂(conodipine M和PLA2),它們基本上不含有二硫鍵。按其作用的受體靶可將芋螺毒素分為α、ω、μ、δ等多種亞型。
芋螺毒素質譜圖冊參考資料。
所有的芋螺毒素具有幾個共同的結構基序,然而在不同的芋螺種中,芋螺肽的序列差異極為顯著。按照芋螺毒素的二硫鍵框架及高度保守的信號肽序列,芋螺毒素可分為若干個超家族,如A、M、O、P、I、S、T等,其中A家族芋螺毒素又分為α-,αA-,κA-三個亞家族。大約一半的已知神經元特異性α-芋螺毒素的三維結構已經確定,其摺疊方式也已有共識———由兩個保守二硫鍵支撐的螺旋區域。這些二硫鍵使α-芋螺毒素具有兩個閉環框架特徵,半胱氨酸殘基和二硫鍵的締結方式在整個序列中是不變的,構成了二環的基本框架。α-芋螺毒素共有的主要胺基酸序列中半胱氨酸殘基的排列:CCXmCXnC(C代表半胱氨酸,Xm和Xn為非半胱氨酸殘基的數量)。一般在上述序列中1/3和2/4半胱氨酸之間形成二硫鍵。半胱氨酸殘基之間胺基酸的數量將α-芋螺毒素分成不同的亞型。這些亞型包括α3/5-、α4/3-和α4/7-芋螺毒素,分別以2/3和3/4半胱氨酸殘基之間胺基酸的數目命名。α3/5-芋螺毒素(CCX3CX5C,如α-GI和MI)拮抗脊椎動物肌肉nAChRs,α4/7-芋螺毒素(CCX4CX7C,如α-MII)對脊椎動物神經nAChRs具有特異的選擇性和親和力。α4/3-芋螺毒素(CCX4CX3C,如α-ImI和α-RgIA)對同聚肽神經nAChRs(α7-α10亞基)和雜聚肽α9α10nAChRs亞基有拮抗作用,而來自Conus purpurascens的α-芋螺毒素PIB(α-PIB)是一種α4/4-芋螺毒素(CCX4CX4C)對脊椎動物神經肌肉nAChRs有高親和性和抑制活性。
芋螺毒素色譜圖冊參考資料。
命名 芋螺毒素的命名規則如下:1個希臘字母表明藥理學活性,1個或2個字母代表芋螺種屬,1個羅馬數字表示二硫鍵框架編號,1個大寫字母表示其變異體。如σ-GⅧA中,σ指出藥理學活性,G代表地紋芋螺(C.geographus),Ⅷ為二硫鍵骨架,而A為該類肽的第一個毒素。若只有克隆基因獲得的成熟肽序列,就用1個或2個字母代表芋螺種屬,1個阿拉伯數字表明半胱氨酸框架,1個阿拉伯數字代表變異體,如Tx5.1、Tx5.2。
空間結構 芋螺毒素(Cys殘基排列方式-C-C-CC-C-C-)肽鏈由24~31個胺基酸組成,分別含有3對二硫鍵成4-Loop框架。Marian Price-Carter等研究了ω-芋螺毒素MVIIA中二硫鍵對該毒素的穩定性和肽段摺疊的影響,發現每個二硫鍵均對毒素的穩定構象有重要貢獻,缺少任何一個二硫鍵都會導致毒素變成不規則的二級結構,大幅度降低與鈣通道的結合能力,並變得更容易被還原。已利用NMR技術獲得了MVIIA,GVIA,MVIIC,MVIID,SVIB,SO3和TxⅦ等ω-芋螺毒素的溶液構象,這些芋螺毒素的整體構象都十分相似,在空間上表現為由3股被轉角連線的反平行β-片層所組成,具有穩定的抑制劑半胱氨酸繩結模體的結構,這種保守的結構正是芋螺毒素能作用於鈣離子通道上的宏位點的基礎,所不同的只是β-片層的長度和β-轉角的類型。芋螺毒素的多樣性及與受體結合的高特異性是由於Loop區核苷酸序列高變的結果,ω-芋螺毒素對鈣離子通道亞型的選擇性也正是因為分子中4個Loop區胺基酸序列的超變異。雖然各種ω-CTX的同源性都比較低,但通常第13位是保守的Tyr殘基,在第5位是保守的Gly殘基,並且通常含有4~6個鹼性胺基酸。
芋螺毒素碎片圖譜 利用核磁共振光譜法可以確定多種芋螺毒素的三維結構。這些小肽很難形成結晶,但也有幾種小肽可以通過X-射線晶體法分析其結構,如具有神經肌肉活性的芋螺毒素GI可以通過這兩種方法分析其結構。儘管芋螺毒素是一種小肽,但是它們卻能摺疊成精細的結構。根據這些結構特徵,有可能確定它們一致的結構特徵。這些結構上的特性明顯受到二硫鍵的締結方式和圍繞第3個半胱氨酸的一個螺旋區域的限制,這種螺旋的典型特徵是覆蓋第5~12位的殘基。環1(Loop 1)的摺疊方式是高度保守的,包括螺旋的第一個轉角。主要的差別發生在環2(Loop 2),最為直觀的表現就是該環包含的殘基數是不等的。然而,即使是在殘基數相等的情況下,在4/7型的芋螺毒素中,環1比環2有更好的重疊程度。在這種情況下,結構的差異顯然是與胺基酸殘基的序列多樣性相關而不是胺基酸殘基的數量。因此,環2的序列多樣性導致了芋螺毒素的多樣性,使其對神經元nAChRs具有特異選擇性。對具有神經元活性的芋螺毒素進行活性結合實驗,有助於研究神經元nAChRs的多樣性和受體特異選擇性,也可能獲得治療神經性疾病的藥物。
芋螺毒素紫外光譜圖 研究發現,毒素分子內部可以自發或經二價陽離子誘發而形成α螺旋結構,Gla在這個過程中起重要作用。在Mg2+-Con-G複合體中,一個Mg2+被Gla3、4、7提供的氧原子穩定,第二個Mg2+與Gla7提供的氧原子相作用,第三個Mg2+與Gla10、14提供的氧原子結合,也即Con-G中存在3個Mg2+結合位點;而Con-T分子內僅有一個Mg2+結合位點。一般認為,生物分子的二級結構能夠影響其活性。而研究發現,α螺旋含量與Con-T及各種類似物活性之間並無相關性。放射性配體結合實驗也未發現Con-G、Con-R分子α螺旋含量與其活性存在嚴格相關性。採用微孔膜通透實驗研究二級結構的改變對Con-G微孔表觀滲透性的影響。結果表明,在Con-G溶液中加入Ca2+,增加其α螺旋結構並未顯著改變Con-G在微孔合成膜上的表觀滲透性。因此,分子二級結構的改變不會對其NMDA受體拮抗活性產生顯著影響,但以上結論僅適用於體外試驗,還沒有整體動物試驗證明該觀點成立。
毒素製備 製備芋螺毒素的方法主要有三種方法。第一種是自天然芋螺毒管中直接提取,此方法獲取量非常少,且由於海洋生態的破壞使得野生芋螺數量急劇減少,該法會進一步加劇芋螺資源惡化,因此靠分離提取獲得大量的芋螺毒素用於研究和生產並不現實,但提取到的少量天然毒液可通過一系列儀器分析手段得到單個毒素肽的胺基酸序列,再根據所得序列人工合成這些肽,可進一步用於活性測試和結構分析。第二種是基因工程方法,即將芋螺毒素的基因轉化到微生物中使其表達,後期再進行分離純化。由於部分芋螺毒素的N端為Cys,醯胺化C端,加之原核表達系統無法加工去除N-端信號肽序列,無法解決醯胺化C端問題,且芋螺毒素分子小,鹼性胺基酸較多,難於形成特定活性構象,使得分離純化較為困難。但隨著基因工程技術的日新月異,用芋螺毒素成熟肽基因,加接原核或真核生物的信號肽,或同時轉入醯胺化酶基因,可望生產出大量廉價的重組芋螺毒素。
芋螺毒素合成路線 人工採集 從芋螺的毒管中可提取少量天然芋螺毒素,大多從野生芋螺的死體毒管中提取。或者引誘活體芋螺刺捕獵物,用乳膠套收集噴射的毒液,可收集到幾微升毒液。為了充足供應芋螺,美國研究人員在農場裡嘗試芋螺的養殖,只養了Conuspurpurascens一種,但還不能辨別活芋螺的性別,也未觀察到芋螺的交配行為,這說明暫時無法人工繁殖芋螺。因而,靠從芋螺體內分離提取獲得大量的芋螺毒素用於研究和生產是不現實的,天然來源的芋螺毒素十分有限,這制約了芋螺毒素研究的開展和套用。但獲得的少量天然毒液可用高效液相色譜儀進行分離和分析,通過質譜儀和序列分析,可得到單個毒素肽的胺基酸序列。
研究中使用的芋螺毒大多數是毒液排出管抽提物。對於大多數芋螺種來說,這些抽提物勉強用於研究。但也有例外,如一種產自東太平洋獵食魚的種類稱為紫紋芋螺(C.purpurascens),其抽提物量不足以用於生化研究。可以先將紫紋芋螺飼養在水中洞穴中,用吹脹的塑膠套子在金魚身上摩擦,芋螺從沙子中跑出來,吸吮著套子,隨套子浮在水面上。或Eppendorf試管,挖去蓋子,放一些魚鰭在試管中,再在魚鰭上面放上一層薄膜,芋螺試圖吸吮試管,便將毒液排入試管中。每收集3-5mL毒液需要耐心地多次用這種方法不停地累積。
基因合成 芋螺毒素是基因直接表達的產物,現代基因工程技術也促進了芋螺毒素的研究與開發。在研究芋螺毒素基因的結構和生物合成過程,尋找新芋螺毒素基因,研究其分子遺傳學機制,蛋白質摺疊機制方面有重要的套用,且已取得了較快的進展。構建芋螺毒素cDNA文庫,從中篩選新芋螺毒素基因已成為研究新芋螺毒素及其分子特徵的重要途徑之一。
μ芋螺毒素基因的串聯 芋螺毒素在體內先合成較大的無活性多肽前體,它們由50~80個胺基酸殘基組成,含有典型的信號肽序列區和可變區,在近成熟肽區位置,有標準的蛋白質水解信號,這些信號肽序列在所有超家族成員中具有保守性。同一超家族的芋螺毒素成員具有高度保守的信號肽序列和高度保守的二硫鍵連線方式。如MVIIC,MVIID,SⅥA,SⅥB和SO3是根據已知ω-毒素毒素肽胺基酸保守序列,合成特定的探針,從中篩選出來的。其他國家已構建了織錦芋螺(C.textile),幻芋螺(C.magus),地紋芋螺(C.geographus),金翎芋螺(C.penaceus)等幾種芋螺的cDNA文庫。同時根據信號肽及3’端非翻譯序列,設計芋螺毒素各個超家族基因的特異PCR引物,從cDNA和基因組DNA中克隆新型毒素基因成為可能,且是分離芋螺毒素基因的主要方法。
研究人員從3種芋螺(C. livi-dus、C.abbreviatus和C.ebraeus)中測出了284個四環芋螺毒素前體蛋白基因序列,又從另外5種芋螺(C. arena-tus,C.pennaceus,C. tessulatus,C.ven-tricosus和C. textile)中獲得了170個芋螺毒素的cDNA序列。他們都在GeneBank中申請了序列號。中國海南淺紋芋螺(C.striatus)和織錦芋螺(C. textile)中也分別發現了6種新O-超家族毒素的cDNA序列和2種α-CTX。地紋芋螺(C.geographus)基因組DNA則用PCR法克隆到新型α-CTX GIC。
中國海南產的大理石芋螺(Conus marmoreus Linnaeus)、幻芋螺(Conus magus Linnae-us)、信號芋螺(Conus litteratus Linnaeus)、勇士芋螺(Conus miles Linnaeus)、獨特芋螺(Conus caracteristicusFischer)、織錦芋螺(Conus textileLinnaeus)、桶形芋螺(ConusbetulinusLinnaeus)、疣縞芋螺(Conus livi-dusHwass)等共12個種中分別發現了具有藥用功能的35種O-超家族芋螺毒素肽及其基因。根據毒素基因推測出相應的毒素胺基酸序列,通過人工合成或基因體外重組表達出這些芋螺毒素,進一步研究其活性,這些毒素即是新藥開發的候選藥物和先導藥物。但部分ω-芋螺毒素的N端為Cys,C端醯胺化,加之原核表達系統無法加工去除N-端信號肽序列,無法解決C-端醯胺化問題,且ω-芋螺毒素分子小,鹼性胺基酸較多,難於形成特定活性構象。
三種芋螺的基因組 DNA 電泳圖 人工合成 採用人工化學合成的方法,即通過分離天然芋螺毒素後測序或採用基因克隆方式獲得芋螺毒素序列,然後採用人工化學合成獲得更多量的芋螺毒素,較多使用的是多肽固相合成法。與傳統的多肽液相合成法相比,該法具有如下優越性:只需經過過濾和沖洗,就可以將產物多肽從可溶性試劑中分離開來;易於使用自動化設備;過量的反應試劑促使反應徹底進行;反應產物多肽一直結合在固相載體上,損失量將達到最小。根據氨基端保護基的不同,固相合成芋螺毒素常用方法為Fmoc法和Boc法。Fmoc法具有反應條件溫和、副反應少等特點,大多芋螺毒素的合成都採用該方法。合成後將肽鏈從樹脂上裂解下來,常用的裂解劑為reagentK試劑(trifluoroaceticacid∶water∶ethanedithiol∶phenol∶thioanisole,90∶5∶2.5∶7.5∶5)。接著脫去側鏈保護基、復性、純化,即可得到與天然毒素活性相同的肽,也可以合成其同系物進行結構和功能的研究。但由於ω-芋螺毒素胺基酸殘基較多,一般都在25個以上,其人工合成的產率較小,純度也低,合成的肽還需氧化摺疊才能形成正確的構象。氧化摺疊的方法有空氣氧化法、DMSO、DTT/cysteine、gluthatione氧化法等。
二硫鍵形成方法示意圖 研究人員在合成ω- CNVIIA時,對這幾種氧化摺疊方法作了比較,發現gluthatione氧化法效果最好。隨後進行純化,即可得到具有天然毒素活性且純度較高的多肽,最後利用NMR技術進行構象分析。因此,人工合成芋螺毒素的成本較高,還不能完全滿足作為藥物商業化生產的要求。但由於芋螺毒素藥物的用量小,效果好,價值高,可部分滿足市場需求。
合成的新技術 隨著對芋螺毒素研究的深入和多肽合成技術的進步,芋螺毒素的合成方法也不斷改進。Ale-wood小組將硒代半胱氨酸引入,合成了3個α-芋螺毒素ImI的類似物。具體操作是用硒代半胱氨酸代替了其中的1對或者2對半胱氨酸,形成二硒鍵替代了原有的二硫鍵,顯著提高了芋螺毒素的氧化摺疊效率,NMR和CD譜都表明類似物和天然的ImI在結構上十分相似,並且保持了原有的生物活性。可採用硒代半胱氨酸代替半胱氨酸合成了μ-芋螺毒素SIIIA類似物,並且使用同位素標記了1對半胱氨酸,在提高了合成效率的同時確定了二硫鍵的連線。
有研究人員在利用
微波合成 法合成了α-芋螺毒素MII的過程中,比較了使用微波合成法和經典的
固相 合成法。結果表明使用微波合成的產率更高,從77%~89%提高到75%-93%。更重要的是使用微波加熱縮短了每個反應周期的時間,由1-2h減少到12-15 min。如果把微波用於環狀肽α-芋螺毒素IMI合成,合成效率也有所提高。此外,芋螺毒素的合成還有很多其它的策略,如μ-MrIA和α-MII採用N-C骨架環化的方法合成。還有科學家利用內醯胺、硫醚等代替二硫鍵,研究芋螺毒素的摺疊產率。
線性肽合成 芋螺毒素的化學合成是獲得芋螺毒素的重要方法,也是進一步研究芋螺毒素活性與結構的基礎。關於芋螺毒素線性肽的合成研究已較深入,合成過程中最主要的問題是二硫鍵如何正確連線。針對不同的芋螺毒素合成,一般是在原有研究基礎上,進一步摸索適宜的保護基團和摺疊方法。線上性肽的合成過程中,應最佳化反應試劑,減少副產物的形成,縮短反應時間,提高合成效率。
芋螺毒素 LtIA線性肽粗肽的色譜圖 自從20世紀80年代中期合成α-芋螺毒素GI和MI以及ω-芋螺毒素GVIA以來,有數百種芋螺毒素肽都通過多肽固相合成法(solidphase peptide synthesis,簡稱SPPS)合成。方向是從C端到N端。每一個胺基酸連線由以下幾個過程組成:首先是去保護,即保護胺基酸必須用一種鹼性溶劑去除氨基的保護基團;其次是胺基酸活化,即下一個連線的胺基酸羧基被一種活化劑所活化;最後是偶聯,活化的單體和游離的氨基反應,形成肽鍵。以上3步循環進行,直至所需的肽合成完畢。
芋螺毒素 LtIA線性肽的質譜圖 在合成過程中,胺基酸保護基團對合成有著重要影響,特別是一些易於氧化的胺基酸,如Met,Trp等,選擇適宜的保護基團可以減少副反應發生。由於芋螺毒素富含半胱氨酸,所以在合成時半胱氨酸保護基團需要慎重考慮。在固相合成中,半胱氨酸有10種以上的保護基團供選擇。這些保護基團對酸鹼或金屬離子的穩定性不同,可以根據這一特點脫去保護基團,從而可以形成游離的巰基、硫醇鹽或者直接脫去保護基團且同時形成二硫鍵,在這個過程中,切割液起著決定性作用。S-Trt、S-Tmob、S-Xan是芋螺毒素合成中常用的半胱氨酸保護基團,對酸不穩定,因此可與其它的保護基團一起用TFA等切割液脫去形成游離的巰基。S-Acm對酸很穩定,可用於Boc或Fmoc合成中,一般用I2或者Tl(tfa)3直接脫去並同時形成二硫鍵,也可以在汞鹽的條件下脫去並形成游離的巰基,這時要注意His,Met,Trp或者Tyr,它們都有可能被氧化。在Boc合成中,最常用的保護基團是S-MeBzl和S-MeOBzl,它們都對TFA很穩定,但可以用HF脫去。若S-Fm用作半胱氨酸的保護基團,就能先於樹脂被脫除。適宜的胺基酸保護基團可以減少合成過程中的副反應,提高合成效率。
多肽固相合成中常用的半胱氨酸保護基團 由於天然芋螺毒素含有特定的
二硫鍵 連線方式,因此如何合成特定二硫鍵連線方式的多肽成為合成中最大的難題,也是限制獲得大量天然芋螺毒素的關鍵因素。在芋螺毒素合成過程中,二硫鍵形成一般通過以下兩種方法:第1種為游離的巰基形成二硫鍵;第2種為半胱氨酸脫保護直接形成二硫鍵;,因芋螺毒素一般含有多對二硫鍵,一般情況下需綜合使用上述兩種方法。游離的巰基形成二硫鍵在芋螺毒素的合成過程中,半胱氨酸的保護基團如果是S-Trt、S-Tmob、S-Xan等,經過切割後就會形成游離的巰基,這些巰基需進一步自由氧化形成二硫鍵。這是芋螺毒素合成最常用的策略。游離的巰基形成二硫鍵的方法有多種,如空氣氧化法、
二甲基亞碸 氧化法、固相
埃爾曼 試劑法、鐵氰化鉀氧化法等。一般認為此法形成的終產物受熱力學控制,反應產物為水,純化步驟少。但由於芋螺毒素含多個半胱氨酸,自由氧化後會形成多種同分異構體。含兩對二硫鍵可以形成3種異構體,如α、ρ、τ、χ等家族芋螺毒素。如果含有6個半胱氨酸理論上會形成15種異構體。研究者已經摸索多種方法,研究體外條件下二硫鍵形成的機制。結果表明芋螺毒素本身的性質和外界因素都對二硫鍵的連線有著一定程度的影響。如Shigeiu等研究了鹽濃度和溫度對ω-芋螺毒素MVIIC摺疊的影響。結果顯示在5℃時氧化的效果最好,天然構象的產率隨著溫度的上升而下降,而2.0mol·L-1(NH4)2SO4可以大大提高ω-芋螺毒素MVIIC的正確摺疊效率。Cruz等研究了去污劑對疏水性δ-芋螺毒素PVIA氧化摺疊的影響,結果表明加入去污劑後天然產物的比例大大提高。Miloslavina等研究了離子化溶液對芋螺毒素摺疊的影響,結果表明離子化溶液可以提高親水性和疏水性肽的氧化摺疊效率。此外,前體肽和二硫鍵
異構酶 作用以及醯胺化等對芋螺毒素二硫鍵形成也都有一定程度的影響。半胱氨酸脫保護定點形成二硫鍵芋螺毒素含有多對半胱氨酸,每一對半胱氨酸可以採用不同的基團保護,合適的脫保護試劑脫去保護基團,定點形成二硫鍵,這是形成芋螺毒素二硫鍵正確連線的常用方法之一,此法可以定點形成二硫鍵,為構象研究提供了方便,但也需要注意Met、Trp等這些敏感的胺基酸可能會發生副反應。含有2對二硫鍵的α-芋螺毒素GI即採用此種方法被合成,其半胱氨酸分別用Acm和MeBzl保護,用HF/anisole脫去MeBzl保護基團,鐵氰化鉀氧化形成第1對二硫鍵,然後利用I2脫去Acm並且直接形成第2對二硫鍵,合成α-芋螺毒素GI時,在脫去MeBzl的同時,樹脂也被切割。而Alewood等對定點合成α-芋螺毒素GI進行了進一步探索,即首先在樹脂上形成二硫鍵,最後切去樹脂,具體為先用巰基乙醇/DIEA/DMF脫去Fm保護基團形成第1對二硫鍵,之後再利用I2脫去Acm並且直接形成第2對二硫鍵,最後才使用HF脫去樹脂。
另外,還有一種新的定點形成二硫鍵的方法,稱為一罐法(One-pot method)。即兩對半胱氨酸分別用t-Butyl和4-methylbenzol基團保護,在5%DMSO/TFA和25℃條件下,t-Butyl保護基團被脫除,再將溫度升高到70℃脫去4-methylbenzol基團。研究人員利用兩步法和一罐法均合成了α-芋螺毒素ImI,並且比較二者合成效率,結果表明一罐法合成效率更高。
O-、M-等超家族芋螺毒素比較特殊,因為含有3對二硫鍵,一般自由氧化和定點形成二硫鍵相結合來合成。如ω-芋螺毒素MVIID,此肽含有6個半胱氨酸。首先用S-Trt保護Cys1,Cys3,Cys4,Cys6,Cys2,Cys5用S-Acm保護。先用切割液脫去樹脂和S-Trt保護基團,形成4個游離的巰基,空氣氧化形成2對二硫鍵,剩下的1對保護基團採用I2脫去並形成第3對二硫鍵。含有3對二硫鍵的芋螺毒素還可以採用三步法合成,即每一步都形成1對二硫鍵。Durieux等利用S-Trt,S-Acm和S-MeOzl3種保護基團,分3步切割形成二硫鍵合成了ω-芋螺毒素MVIIA。
分子生物學特徵 編碼 分子生物學研究結果表明,大約有5~10個主要芋螺毒素基因超家族編碼80%以上的芋螺毒素。超家族又分化為結構與功能不同的若干芋螺毒素族,毒素族具有特定的毒理作用靶位,毒素族的各個成員分別專一性的作用於不同類型或亞型靶位分子。芋螺毒素的這種分子多樣性對於芋螺的生存競爭有著重要意義,為了適應此種生態環境,α-芋螺毒素的分子結構不斷進化,其二硫鍵間的loop環節與胺基酸組成發生變異。
芋螺毒素胺基酸序列 每個芋螺毒素均由單一的mRNA編碼,通過核糖體翻譯機制進行生化合成,原始翻譯產物是一種特定的前蛋白原前體化合物,約為70~120AA,包括一個大約20AA的N-端信號肽,一個中間前體段和一個大約10~30AA的成熟毒素段,成熟毒素段常為由C-端編碼的單一拷貝區段,生成的毒素片段可在經過不同程度的翻譯後修飾,許多芋螺毒素是基因多肽產物中高度翻譯後修飾的產物。前蛋白原前體的不同區段的進化速率很不相同,同一超家族的信號肽段是高度保守的,與之相反,成熟毒素段卻是高突變的,可能前蛋白原的信號肽段、中間前體段和成熟毒素段是分別由不同的較小的外顯子編碼形成,這些外顯子被較大的內含子片段相互隔斷,內含子片段可以調控複製、重組等功能,使前體分子C-端部分加速進化。芋螺毒素的多樣性主要來源於成熟毒素段的高突變作用,在一定進化時段內,芋螺毒素利用組合庫方式或稱為盒式轉化機制的方式快速構造新的毒素多肽序列,同時保留高度保守的二硫鍵排布方式。前蛋白原前體中有一個可由翻譯後修飾酶類識別的特殊信號肽段,多種翻譯後修飾過程進一步生成更多新序列的芋螺毒素分子。常見的翻譯後修飾方式有谷氨酸的γ-羧基化,大約有20%的芋螺毒素存在γ-羧基谷氨酸,使之利於阻斷NMDA受體。另一種翻譯後修飾方式是L-氨基的胺基酸的差向異構化作用,將色氨酸與亮氨酸轉換成D-型,則可以提高其對某類亞型受體的特異性。
由於芋螺毒分子生物學研究起步較晚,故對其結構特徵了解較少。在基因水平上已闡明來自食螺芋螺,織錦芋螺的σ-TXIA,σ-TXIB和σ-TXIIA(KK肽家族)的結構特徵。對其CDNA克隆進行分析獲知,這3種毒素的多肽前體由7778個胺基酸殘基(AA)組成,編碼N端51個AA的核苷酸序列為保守區,其中包括一個插入序列(29個AA)和一個信號序列(22AA),在成熟肽中,該部分被加工去除,C端為成熟肽區域,由26~27個AA組成,6個Cys 100%保守,位於它們構成的環狀區的AA具有高變性,即每改變一個AA就有可能形成一種新的芋螺毒素。芋螺毒素在體內先合成較大的無活性多肽前體,多肽前體翻譯後加工過程可能是:①由信號肽酶將N端信號肽序列連同插入序列一起切除;②前體的C-末端序列為:X-Gyl-Y-B,B是鹼性AA(Arg或Lys),Y是鹼性AA或其它AA。在KK肽中Y是Lys,在GVIA中Y是Thr,X是成熟肽C末端AA。先由特異的羧肽酶將C-末端AA切除,之後由一種特殊的α-醯胺化酶將Gly切除,並將X醯胺化。不同種芋螺多肽前體C-末端AA序列不同,表明不同種芋螺在進化中可能形成了特異性不同的酶。芋螺毒素肽翻譯後加工的過程中,二硫鍵交叉形成可能是受到每個肽超家族專一分泌途徑中特別細胞組分的援助。每個超家族的高度保守信號序列在每個肽靶向其適合的分泌途徑起著特殊的作用。從芋螺基因的分子分析,表明肽前體的不同片段是以相當不同的速率進化的。在同一超家族中的肽的信號序列是相當保守的,相反,成熟毒素肽區是超變異的。至少在一些超家族,信號序列、前區和成熟毒素肽區分別由不同的小外顯子編碼,這些小外顯子被大內含子相互間隔開。因為大內含子可能調節著複製、重組事件,導致前體C端的加速進化和N端十分保守。
芋螺毒素結構模擬圖 芋螺毒素肽表現出分子多樣性是通過成熟毒素肽區的超突變,芋螺在進化歷程上正使用一種重組戰略以便在毒液中產生新的肽序列,同時保留肽的基本結構框架。因此,很顯然,芋螺毒液是芋螺捕獲獵物的主要武器,也可能被當作其它生物學目的(如防衛)。毒液的內容物以很多方式提供了生物體相互作用的生化反射,這種生化反射對該芋螺的競爭勝利或失敗是必需的。在一個特殊芋螺種競爭勝利的小生態環境中,可能對毒液的個別組分有連續性的自然選擇。當一個新的種進化時,也許因為環境突然改變,捕食者、被捕食者和競爭者三者變化著的關係可能對毒液的其他組分產生新的和巨大的選擇壓力。在這些不穩定因素下,毒液的組分明顯成熟過度,以致於在相對短的時間內,新種的出現伴隨著為適應已改變了的生態小環境而其毒液肽的新組成的出現。因此,可論證地說,芋螺屬已變成所有海洋無脊椎動物屬中物種最豐富的屬。通過這種擴增成數百種種,毒液的基本戰略保持相同:即幾個基因超家族的多樣化衍生出來的小的結構肽類,強力地影響捕食者、被食者和競爭者的神經系統。
翻譯 芋螺毒素是所發現的翻譯後加工最為複雜的生物多肽。成熟毒素段的高度翻譯後修飾則是芋螺毒素多樣性的另一個重要途徑。蛋白前體中有一個可由翻譯後修飾酶類識別的特殊信號肽段。多種翻譯後修飾過程進一步生成更多新序列的芋螺毒素分子。常見的有谷氨酸γ-羧基化、脯氨酸羥基化、C末端醯胺化,此外還有一些罕見的修飾,例如絲氨酸和蘇氨酸的糖基化、溴代色氨酸、D型胺基酸、酪氨酸磺基化等。
μ芋螺毒素基因序列分析圖 CTx中A-超家族芋螺毒素中最常見的加工方式是C端的醯胺化和脯氨酸的羥基化;另一種翻譯後修飾方式是L-氨基的胺基酸的差向異構化作用,將色氨酸或亮氨酸轉換成D-型,則可以提高其對某類亞型受體的特異性。同時發現了一些其他的修飾,如Ser糖基化及Tyr的磺基化等。芋螺毒素分子的翻譯後修飾的重要作用在於可使單一基因生成結構不同的多類肽分子結構,大大增加了芋螺毒素分子的多樣性。通過翻譯後修飾也可以生成不同於母體分子結構的新肽分子模體,提高對靶位分子的識別能力與專一性,同時這些結構變化也常能提高芋螺毒素對蛋白酶的抗性。另一些翻譯後修飾的重要作用是改變其物理化學性質,如絲氨酸和蘇氨酸的羥基的O-糖基化作用可增加毒素分子的穩定性以及與膜轉運分子的親和性,苯丙氨酸的鹵化作用可以增加分子的脂溶性,使之易於透過血腦屏障,進入中樞神經系統。動物實驗研究表明,達到同樣的活性需要的劑量未糖基化的比糖基化的高10倍,顯然O-糖基化增加了毒素的效率。這些胺基酸的修飾與加工均需要特定的酶,同時也需要相應的識別序列或者特徵結構,對芋螺毒素而言,對其結構與功能至關重要的可能是蛋白質二硫鍵異構酶(protein disulfide isomerase,PDI)。
殘基的影響 放射性配體結合實驗常用於評價單個胺基酸被替代後的活性。由於Gla比較特殊,首先引起人們的關注。研究發現,Con-G[γ4A]活性完全喪失;Con-G[γ3A]活性較原肽段下降20倍;Con-G[γ10A]、Con-G[γ14A]活性無明顯改變;Con-G[γ7A]對嚙齒類動物和人類神經細胞,活性均增加4倍,這表明,Con-G中第4位Gla很重要。對Con-T的研究表明,3位Gla替換對原肽段活性影響較大;4位Gla為維持活性所必需,無論用何種胺基酸替換後,所得類似物均無活性。10位Gla被取代後活性稍降低,14位Gla被替換後活性增加1倍。放射性配體結合實驗研究除Gla以外其他胺基酸發現,Con-T[Q6A]活性增加兩倍,其餘類似物活性均不同程度下降。這說明Con-T中,第6位胺基酸重要性相對小,其餘胺基酸對於維持Con-T活性都是必需的。全細胞電壓鉗實驗結果表明,Con-G的5位Leu和Con-T的10~21位胺基酸是影響其配體-NMDA受體亞基選擇性的重要因素。所以,進行conantokins分子改造時不僅要保留重要胺基酸位點,而且還要儘量保留影響配、受體亞基結合的結構。以便在提高conantokins類似物活性的同時,保持其與NMDA受體相對高的親和力。
N端相對保守,對於維持肽段活性意義重大,分子設計應該儘量不作改變;C端相對次要,在有限的範圍內減少若干胺基酸殘基,雖然肽段活性降低,但可通過增大給藥劑量來維持原有效應,且減少胺基酸數目可縮小分子,有可能使conantokins經外周給藥即可透過血腦屏障進入中樞,簡化其給藥方式。
毒理學 毒性 20世紀60年代在澳大利亞首次發現芋螺獵食魚類。研究證實不同芋螺毒具有不同的生物活性組分。1997年從芋螺毒中純化一個活性肽,並成功測定了其胺基酸組成,這個肽就是μ-芋螺毒素。第一個被弄清胺基酸序列並被化學合成驗證了的芋螺毒活性肽是α-芋螺毒素GI,它是從地紋芋螺(Conus geographus)毒中純化出來的,含2個二硫鍵,由13個胺基酸殘基組成,是一種菸鹼能型強拮抗劑,其作用類似於蛇毒神經毒素(如α-bungarotoxin,Cobratoxin)。緊接著從地紋芋螺毒中分離鑑定出另一種活性肽,是鈉通道的阻斷劑,其作用類似於Tetrodotoxin和Saxitoxin,它可引起哺乳動物麻痹反應。這兩種肽是引起采螺人死亡的主要原因。
芋螺毒素在肌肉接頭部位作用模擬 通過觀察了對小鼠和金魚注射contryphan-R後的行為學表現發現,對金魚肌肉注射後,金魚很快出現震顫、麻痹等症狀。對小鼠顱腔注射時,低劑量(0.5~6.0nmol/g)可產生騷抓、舔咬、豎尾、桶狀翻滾症狀等;高劑量(8~20nmol/g)則會表現出抽搐、驚厥、癱瘓乃至死亡。產生這些行為學異常的具體機制尚不清楚。芋螺毒素特異性地作用於多種離子通道與神經受體,對魚的毒性多在1~10μg/Kg之間。
芋螺毒活性肽 20世紀80年代初,美國猶它大學的研究人員直接將芋螺毒組分注射到哺乳動物中樞神經系統,而拋開當時該實驗室乃至大多數實驗室已長期慣用的所謂的標準方法即腹腔內膜注射法(i.p.),結果顯示,用顱腔注射法引發了大量的小白鼠不同的行為症狀反應,這揭示了芋螺毒的藥理多樣性;而用i.p法,只有很小比例的小白鼠產生穩定可測的症狀反應。為了進行針對性研究而從這些症狀反應中選擇了一種“似睡”現象,把從芋螺毒中分離出的控制這種“似睡”現象的活性組分命名為“睡蟲”肽(sleeper),它能使年齡不到14天大的小白鼠進入“似睡”狀態。而如果將這種“睡蟲”肽注射到年齡為21天大的小白鼠顱腔,小白鼠卻表現出超活躍症狀反應,即小白鼠不停地在籠子四周邊緣攀爬且從一角落跑到另一個角落。正因這種肽能誘發不同年齡大小的小白鼠表現出不同的症狀反應,所以人們又將其稱為“睡蟲或爬蟲”(sleeper or cleeper)肽。還有人從芋螺毒中純化了“搖盪”肽(shaker),該肽引發小白鼠顫抖。
逐漸減少睡眠肽的C端胺基酸殘基後其活性逐漸下降,保持其活性存在的最短肽段為Con-T。而減少Con-R的C端胺基酸殘基數目,其活性下降不是十分明顯,Con-R尚且能夠保持原始肽段活性不變,但是從Con-R開始,活性便逐漸下降,保持Con-R活性存在的最短肽段為Con-R。Con-G活性受C端胺基酸殘基數目影響較大,Con-G活性逐漸降低,保持Con-G活性存在的最短肽段為Con-G。Blandl等發現,Con-R誘導小鼠睡眠持續時間為2~4 h,小於Con-R引發的6~8 h睡眠時間。由於放射性配體結合實驗顯示兩肽段的活性相同,因此推斷是由於Con-R分子C端的二硫鍵結構導致其體內半衰期延長,進而延長了小鼠睡眠持續時間。
從幻芋螺(C.magus)毒中純化的“搖盪”肽(shaker peptide)和從地紋芋螺(C.geographus)毒中發現的另一個“搖盪”肽都能抑制青蛙神經肌肉連線處的鈣流和突觸傳遞。這表明“搖盪”肽可能作用於控制神經遞質釋放的一種新型鈣通道。採用電生理技術分析鑑定新鈣流研究“搖盪”肽影響鈣通道及鈣流,結果發現了一種新型鈣導,即N-型鈣流,這些“搖盪”肽專一地強有力地抑制N-型鈣流。這些“搖盪”肽就是μ-conotoxinGVIA和μ-conotoxinMVIIA。在神經科學領域,μ-conotox-inGVIA可能會成為僅次於Tetrodotoxin的一種研究工具探針,因為它在抑制突觸傳遞和判斷N型鈣流是否存在這兩方面很有用。
協同作用 芋螺毒液中均存在眾多的不同化學結構的芋螺毒素,但是它們並不是隨機性的化學產物,而是有重要生物意義的不斷進化最佳化而生成高生物活性肽,在毒理作用上它們之間具有密切的協同作用,在實現其捕食其他生物的過程中,芋螺並不依賴於某一單一毒素的作用,而是依賴於芋螺毒液中各種毒素的組合作用機制來實現。例如,地紋芋螺毒液中既含有高強度的nAChR拮抗劑(ω-芋螺毒素,又含有Na+通道阻斷劑μ-芋螺毒素,前者作用類似於α-銀環蛇毒素,後者作用類似於河豚毒素,在這兩類芋螺毒素的共同作用下,導致神經肌肉傳導完全阻斷。
芋螺毒素構象圖冊參考資料。
芋螺毒素的組合作用機制突出的表現為不同毒理作用之間的協同組合上,亦即以高度組織化的“毒素集團”發揮其功能。已經了解的此種組合作用機制有兩種模式。一種模式稱為“休克+麻痹”作用,如紫芋螺(C.purpurascens)有兩類不同作用的毒素,一類毒素可致被捕食生物立即產生類似電休克式的強直性癱瘓的快速作用,此類芋螺毒素包括可抑制Na+通道失活的δ-芋螺毒素以及抑制K+通道的κ-與κA-芋螺毒素,這些毒素可迅即使軸突纖維完全去極化,導致休克症狀。紫芋螺毒液中的另一類毒素包括多類α-及μ-芋螺毒素,則可完全阻斷神經肌肉傳導,使被捕食生物長時間癱瘓,在這兩類不同作用的毒素的共同作用下,紫芋螺等一些食魚芋螺,既可以迅速捕捉魚類,又能從容的吞食它們。另一種模式稱為“安定+麻痹”作用,如地紋芋螺,被捕食生物進入其口腔時,並不發生被刺咬時常出現的驚厥狀況,而是非常安靜,表明地紋芋螺使用了不同於“休克+麻痹”的另一種模式,地紋芋螺中富含Conantokin-G、Contulakin-G等芋螺睡眠肽類,這些肽類可使被捕食生物感覺系統鈍化失活,處於安定睡眠狀態。然後再在α-及μ-芋螺毒素的作用下,進入麻痹癱瘓期,達到捕食目的。
離子通道 電壓門控離子通道超家族是由一大族結構相似的膜結合蛋白組成的,它們受跨膜電壓變化的激活。這些蛋白質對單價陽離子具有不同的選擇性,按照慣例被分為Ca2+,Na+,和K+通道。這些離子通道的最重要的生理作用是促使細胞電信號的產生、調整和轉換。電壓門控離子通道的主要孔洞形成α-亞基是由含有4個同源結構域的單一亞基組成的(如Na+和Ca2+通道),或由4個不同的亞基組成(如鉀通道)。α-亞基與輔助亞基相互作用並不是完整地形成一個孔洞,而是改變α-亞基的特性。在某種生理狀態下,當電壓門控離子通道被激活時,會經歷一個構象變化,致使陽離子選擇性地透過通道蛋白的孔洞。這種處於開放狀態的電壓門控離子通道可被其另外一種構象變化失活、從而使通道進入不傳導狀態,或者回到關閉狀態。電壓門控離子通道是多種生物毒素的作用靶標。越來越多的可與Na+,K+,和Ca2+通道的成孔α-亞基相互作用的芋螺毒素家族被研究鑑定。已知有3個不同的芋螺毒素家族作用於電壓門控離子通道,μ-CTX是Na+通道阻斷劑、μO-CTX抑制Na+通道的電導率、δ-CTX延遲或抑制Na+通道的快速失活。只有ω-CTX作用於Ca2+通道。
Ca2+通道為所有興奮性細胞膜的必要成分之一,Ca2+通道是由4或5個不同的亞基組成的複合物。觀察到的Ca2+通道在生理學和藥理學上的多樣性主要是由成孔α1-亞基的特性形成的。據此可分為L,T,N,P,R和Q類型,其中N類型的Ca2+通道只存在於神經元組織(如脊椎動物的中樞神經系統以及外周神經系統),它主要抑制神經遞質尤其是去甲腎上腺素從交感神經上釋放時Ca2+的進入。基於不同的生理學和藥理學特性,電壓敏感性鈣通道(鈣通道)由3個鈣通道家族組成,L-型鈣電流的通道屬於Cav1家族;P/Q-、N-、R-型鈣電流的通道屬於Cav2家族;T-型鈣電流的通道則屬於Cav3家族。其中L-型參與一些興奮-收縮∕分泌偶聯和心肌的活動;T-,N-,P-,Q-和R-型參與神經遞質的釋放。
芋螺通過其魚叉樣小毒箭螫刺傷與其接觸的裸潛、捕撈人員、游泳者及其他海洋作業人員,造成局部皮膚損傷,毒素吸收後導致全身中毒。誤食或吃法不當也可引起全身中毒。尚無有效的治療方法,一般採用對症療法和支持療法。
藥理學 作用機制 在藥理學上,芋螺毒素表現為配體和電壓門控的NM-DA受體非競爭性拮抗劑。NMDA受體屬於離子型谷氨酸受體亞家族,介導Ca2+跨膜內流,為興奮性胺基酸受體,由3種亞基組成:NR1、NR2(A-D)和NR3(A-B)。NR1是功能亞基,可單獨構成離子通道,NR2和NR3是調節亞基,不能單獨構成離子通道,分別增強或抑制NR1亞基的功能。NMDA受體發揮功能至少需要NR1和NR2的表達,NR3不是NM-DA受體發揮功能所必需的。研究發現,Con-G特異性拮抗含NR1/NR2B亞基的NMDA受體,Con-T與Con-R拮抗含有NR1/NR2A/NR2B及NR1/NR2B亞基的NMDA受體,而同種conantokins的不同類似物對NMDA受體的拮抗活性也存在差別。由於NMDA受體的亞基組成在生物發育過程中存在時空特異性以及疾病發生、發展過程中的階段特異性,因此,芋螺毒素對疾病不同發展階段和不同部位可能存在不同作用。
研究發現,Conantokins4個成員N端前4位胺基酸殘基均相同,為分子中的保守序列,足以說明該結構的重要,Con-R與Con-L甚至N端前15位胺基酸均相同。而Con-R對噪聲誘導驚厥小鼠的保護指數為17.5,而Con-L的保護指數僅為1.2,表明二者C端序列差異是影響其抗驚厥活性的主要因素。研究發現,Con-R的N端前5位胺基酸殘基中任何一個發生改變,多肽的活性都要下降11~1000倍,因此認為Con-R與NMDA受體結合併發生作用的關鍵序列就是這5個胺基酸殘基以及緊隨其後的兩個轉角並與其位於α螺旋同一側面的其他胺基酸殘基。
抗癲癇 研究顯示,癲癇病人NMDA受體NR2B亞基的mR-NA較對照組增高,表明NMDA受體NR2B亞基功能上調可能參與癲癇發病,選擇性作用於NR2B亞基的Con-G可能具有治療癲癇的潛力。動物實驗顯示,Con-G抗大鼠癲癇的半數有效劑量(median effective dose,ED50)在噪聲誘發組為3.5 pmol;電擊誘發組為25.9 pmol;戊四唑誘發組為28.7pmol;木防已苦毒素誘發組為50 pmol,這表明Con-G對不同原因引起的癲癇都有潛在治療作用,顯示出廣譜、高效的抗癲癇活性。與其他NMDA受體非選擇性拮抗劑相比,Con-G可劑量依賴性地阻斷刺激大鼠角膜激發的癲癇發作。側腦室單次注射Con-G顯示出快速、持久的藥效。通過比較,Con-G的作用特點類似廣譜抗癲癇藥2-丙基戊酸鈉。研究還發現,Con-G與其他NMDA受體拮抗劑以及標準抗癲癇藥相比,其有效劑量(ED50)與毒性劑量(TD50)跨度更大。此外,Con-R也被證明在4種動物癲癇模型上效果優於艾芬地爾(ifenprodil)和地佐環平(dizocilpine,MK-801),側腦室微量給藥即可阻斷噪聲誘發小鼠癲癇發作,並可部分阻斷癲癇陣攣發作,且該劑量遠低於毒性劑量。這表明,Con-G、Con-R在有效治療劑量範圍內不引起毒性作用,安全性比現有抗癲癇藥物更好。
抗慢性疼痛 含NR2B亞基的NMDA受體在痛覺信息傳遞和痛覺敏化的形成過程中扮演重要作用。因此,針對NR2B亞基的NMDA受體拮抗劑conantokins具有對疼痛潛在的治療作用。有研究表明,給小鼠鞘內注射Con-G和Con-T,均能減輕福馬林誘導的Ⅱ相痛、坐骨神經結紮後的痛覺過敏和弗氏完全佐劑(Complete freund’sAdjuvant,CFA)導致的誘發痛。另外,它們發揮鎮痛作用的劑量和出現副作用的劑量相差20倍以上。這表明,Con-G和Con-T在有效的鎮痛劑量範圍內幾乎無任何副作用,是一種理想的鎮痛藥物。
抗腦缺血損傷 NMDA受體過度激活可以造成胞內Ca2+超載,引發細胞死亡,採用conantokins治療腦缺血損傷成為新近研究的熱點。Williams等採用SD大鼠胚胎腦細胞進行研究發現,Con-G將十字孢鹼(staurosporine)誘導的細胞凋亡存活率提高60%,高於艾芬地爾和地佐環平,在此基礎上他們發現Con-G能夠顯著減少大腦中動脈阻塞大鼠腦梗死面積,具有8h的保護期。此外,Con-G不僅能夠有效減少中腦動脈阻塞大鼠梗死灶細胞c-fos的基因表達,且能夠增加抗凋亡基因bcl-2陽性細胞數並減少損傷區域DNA斷裂數量。這表明Con-G具有潛在的神經細胞保護作用,提示其具有抗腦缺血損傷的潛力。
抗藥物成癮 由於NMDA受體參與精神活性物質獎賞效應的形成,因此conantokins對於精神活性物質成癮具有潛在干預作用。魏娟娟等觀察到Con-G使嗎啡依賴小鼠平均跳躍次數減少89%,並呈劑量依賴性,相同劑量Con-G[S16Y]可完全抑制嗎啡依賴小鼠戒斷跳躍;而Con-R[1-17]僅使嗎啡依賴小鼠平均跳躍次數減少40.2% ~58.3%。可見,Con-G和Con-G[S16Y]抗嗎啡依賴藥效強於Con-R[1-17],其原因可能是Con-G和Con-G[S16Y]對NMDA受體NR2B亞基的選擇性高於Con-R[1-17]。
其他 Conantokins對帕金森病也顯示出一定治療作用。給帕金森病大鼠注射Con-G進行干預,發現它能夠呈劑量依賴性地加強左旋多巴誘導的大鼠旋轉。另一項研究表明,Con-G可以增強甲基苯丙胺誘導大鼠的行為學效應。其原因可能是甲基苯丙胺可以促進多巴胺釋放,Con-G給藥間接增強了多巴胺激動劑的藥效。該結果提示,conantokins具有治療帕金森病的臨床套用潛力。
芋螺毒素藥用研究的其他方向還有:具有去甲腎上腺素轉運蛋白抑制作用的T家族芋螺毒素,可用於治療抑鬱症。以及抑制α1-腎上腺素受體的一些芋螺毒素,可用於治療良性前列腺過度增生引起的尿失禁。
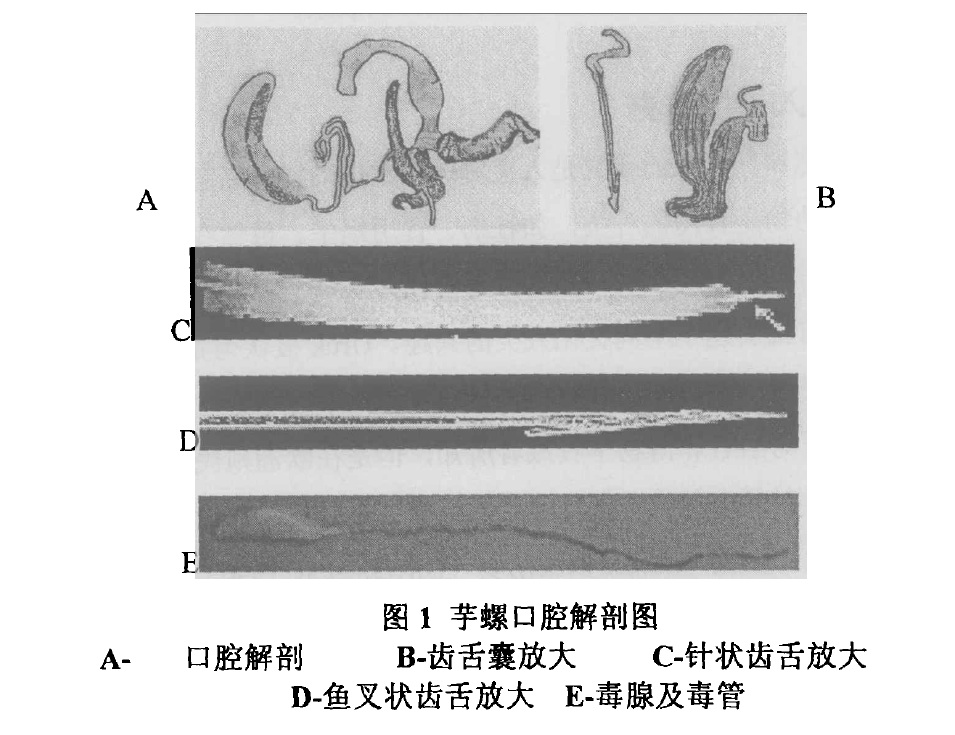 芋螺口腔解剖圖
芋螺口腔解剖圖 芋螺毒腺
芋螺毒腺 芋螺捕食過程
芋螺捕食過程 A-超家族芋螺毒素的序列分析
A-超家族芋螺毒素的序列分析 I-超家族芋螺毒素的前體序列
I-超家族芋螺毒素的前體序列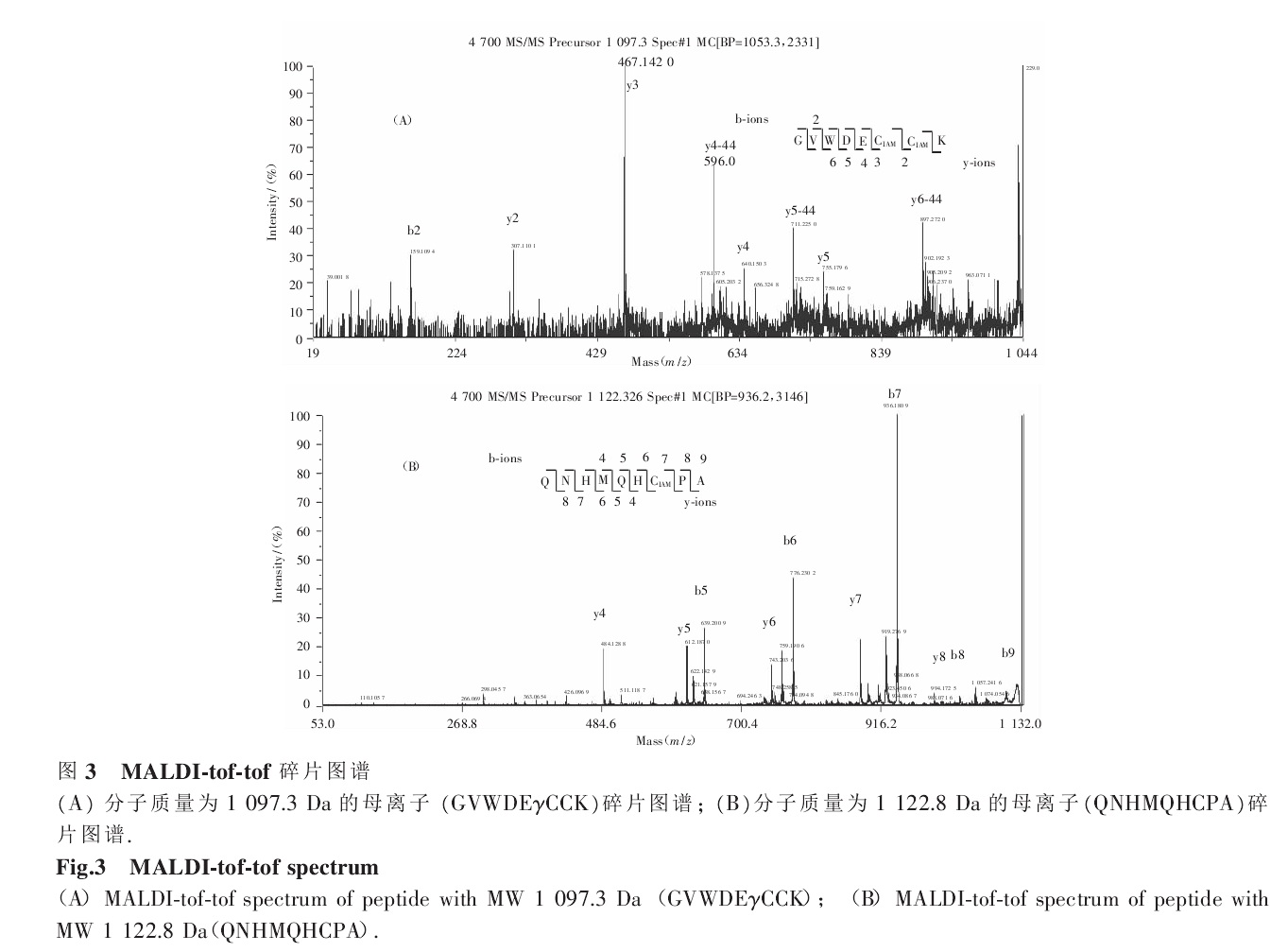 芋螺毒素碎片圖譜
芋螺毒素碎片圖譜 芋螺毒素紫外光譜圖
芋螺毒素紫外光譜圖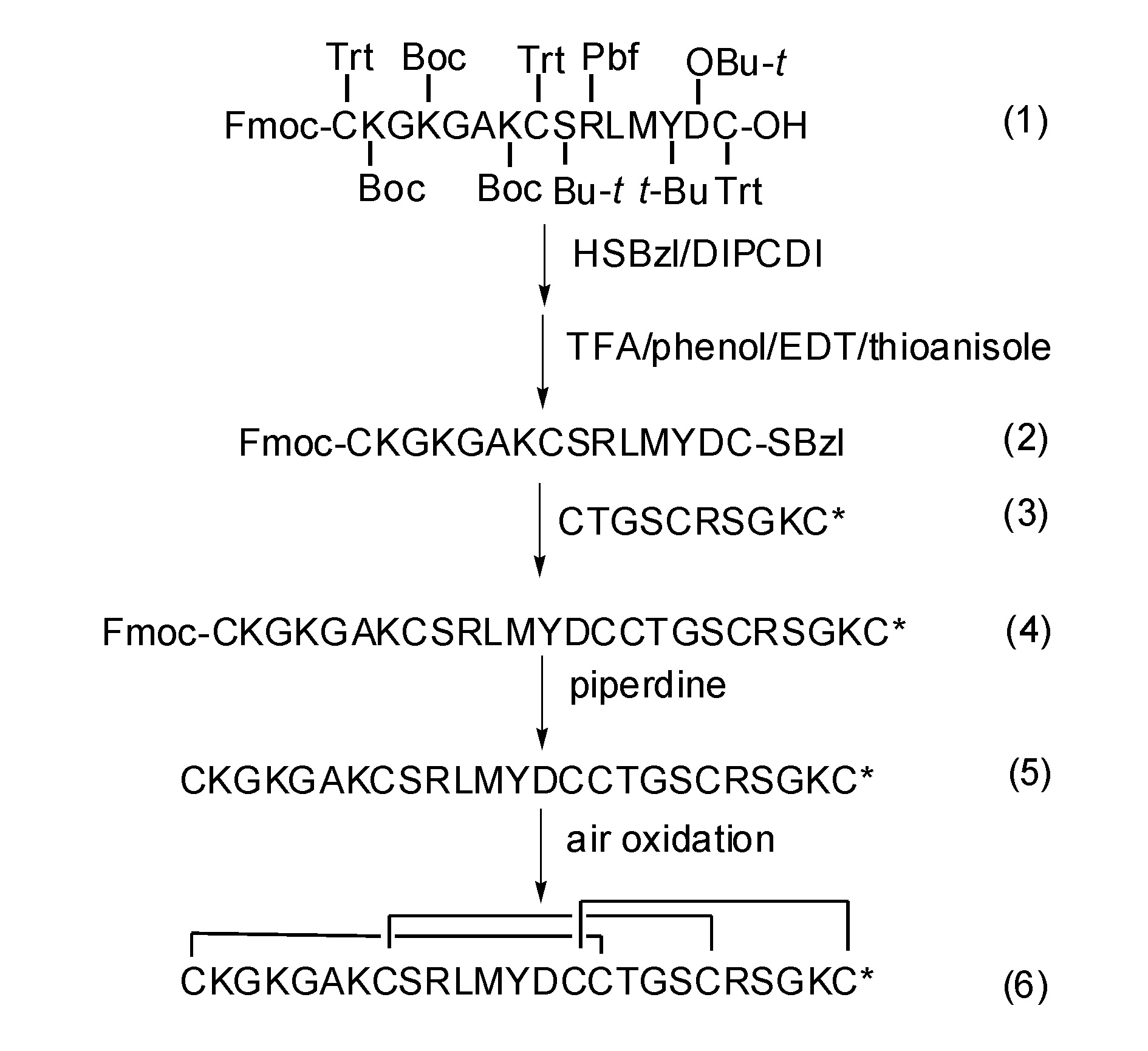 芋螺毒素合成路線
芋螺毒素合成路線 μ芋螺毒素基因的串聯
μ芋螺毒素基因的串聯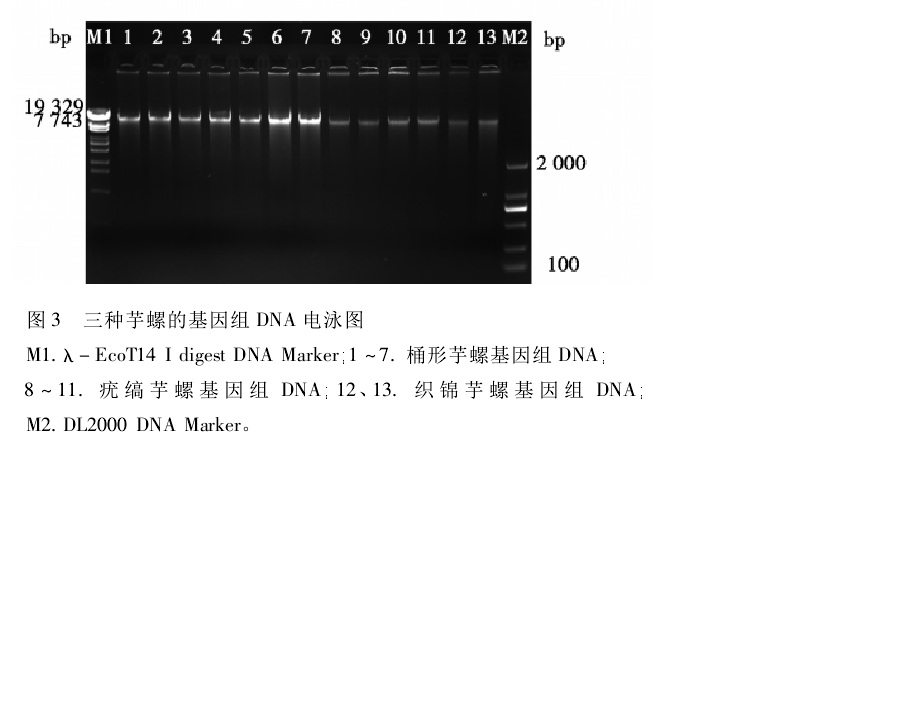 三種芋螺的基因組 DNA 電泳圖
三種芋螺的基因組 DNA 電泳圖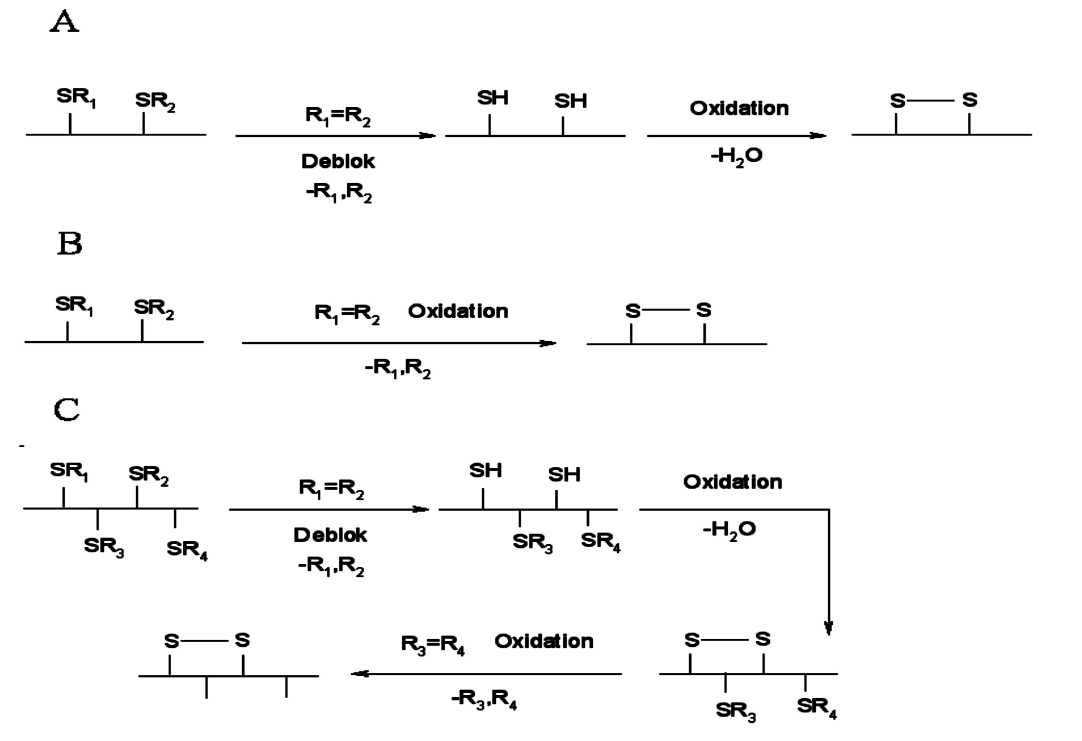 二硫鍵形成方法示意圖
二硫鍵形成方法示意圖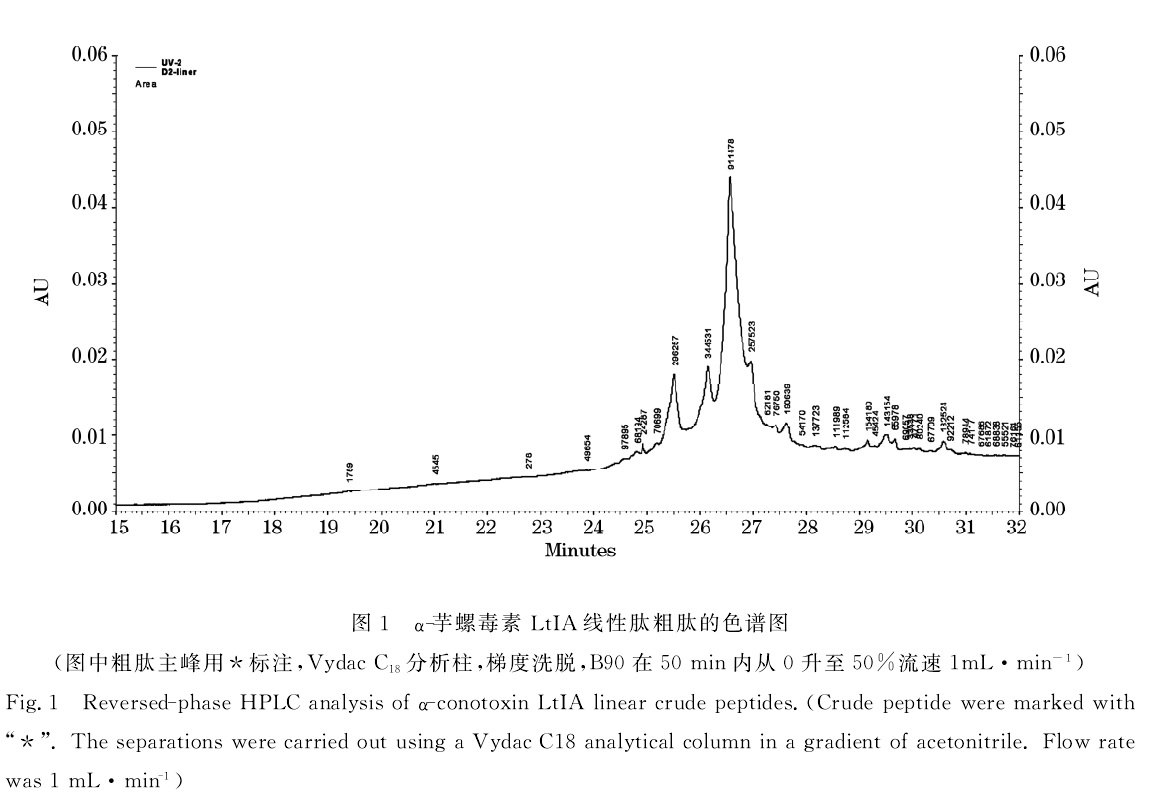 芋螺毒素 LtIA線性肽粗肽的色譜圖
芋螺毒素 LtIA線性肽粗肽的色譜圖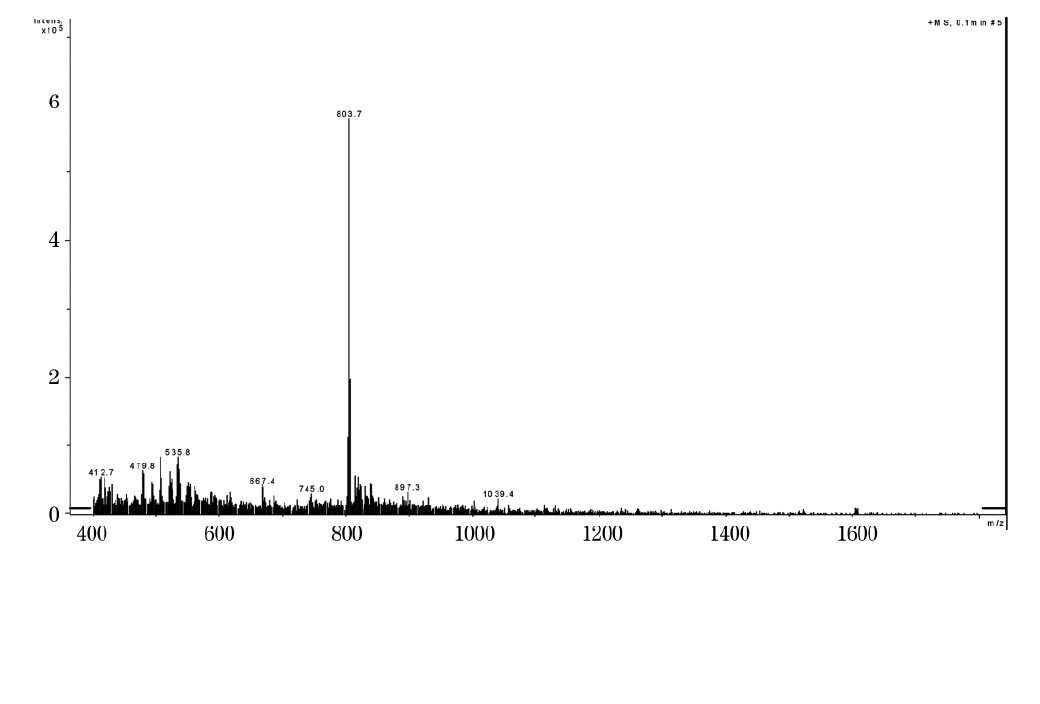 芋螺毒素 LtIA線性肽的質譜圖
芋螺毒素 LtIA線性肽的質譜圖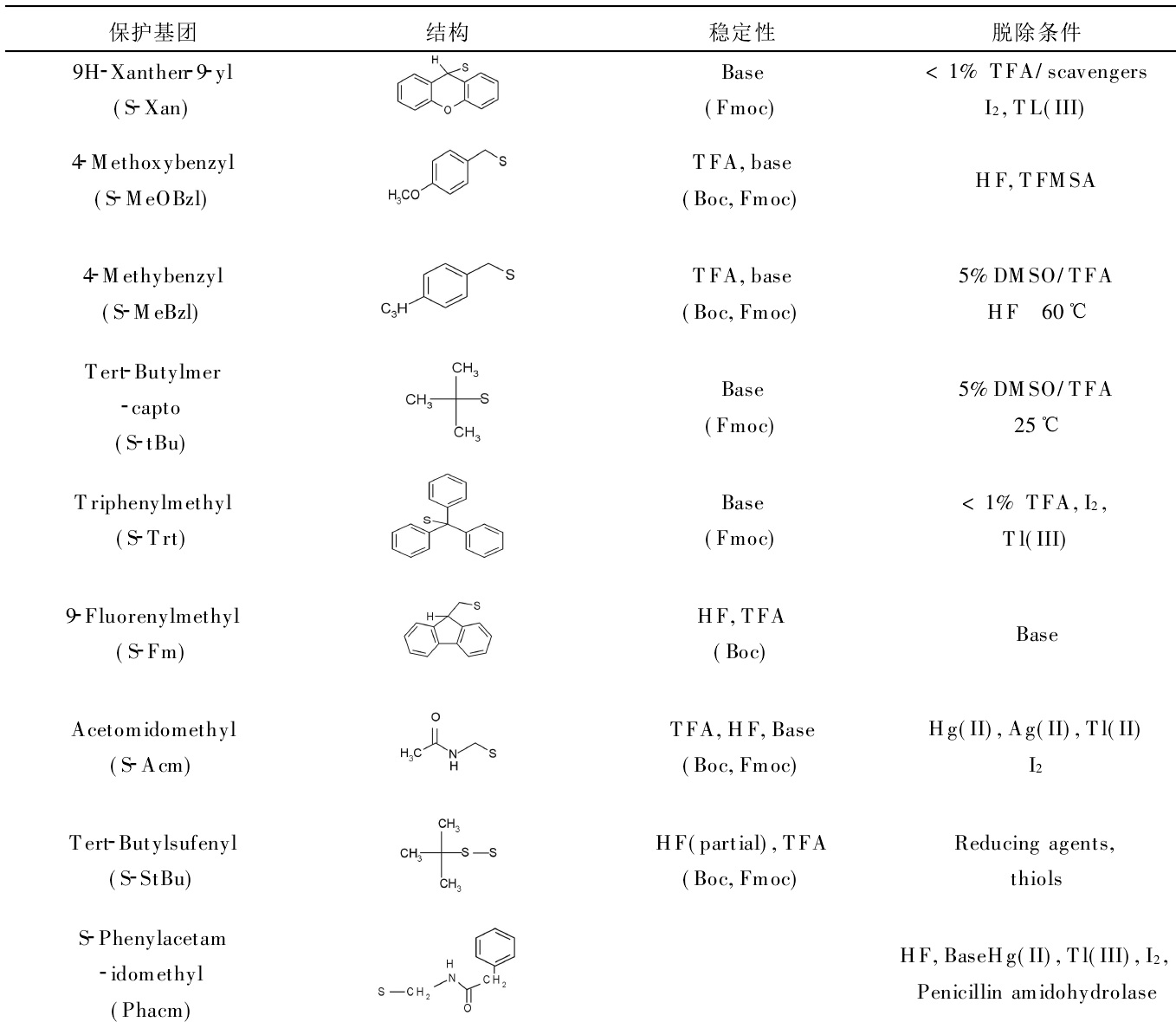 多肽固相合成中常用的半胱氨酸保護基團
多肽固相合成中常用的半胱氨酸保護基團 芋螺毒素胺基酸序列
芋螺毒素胺基酸序列 芋螺毒素結構模擬圖
芋螺毒素結構模擬圖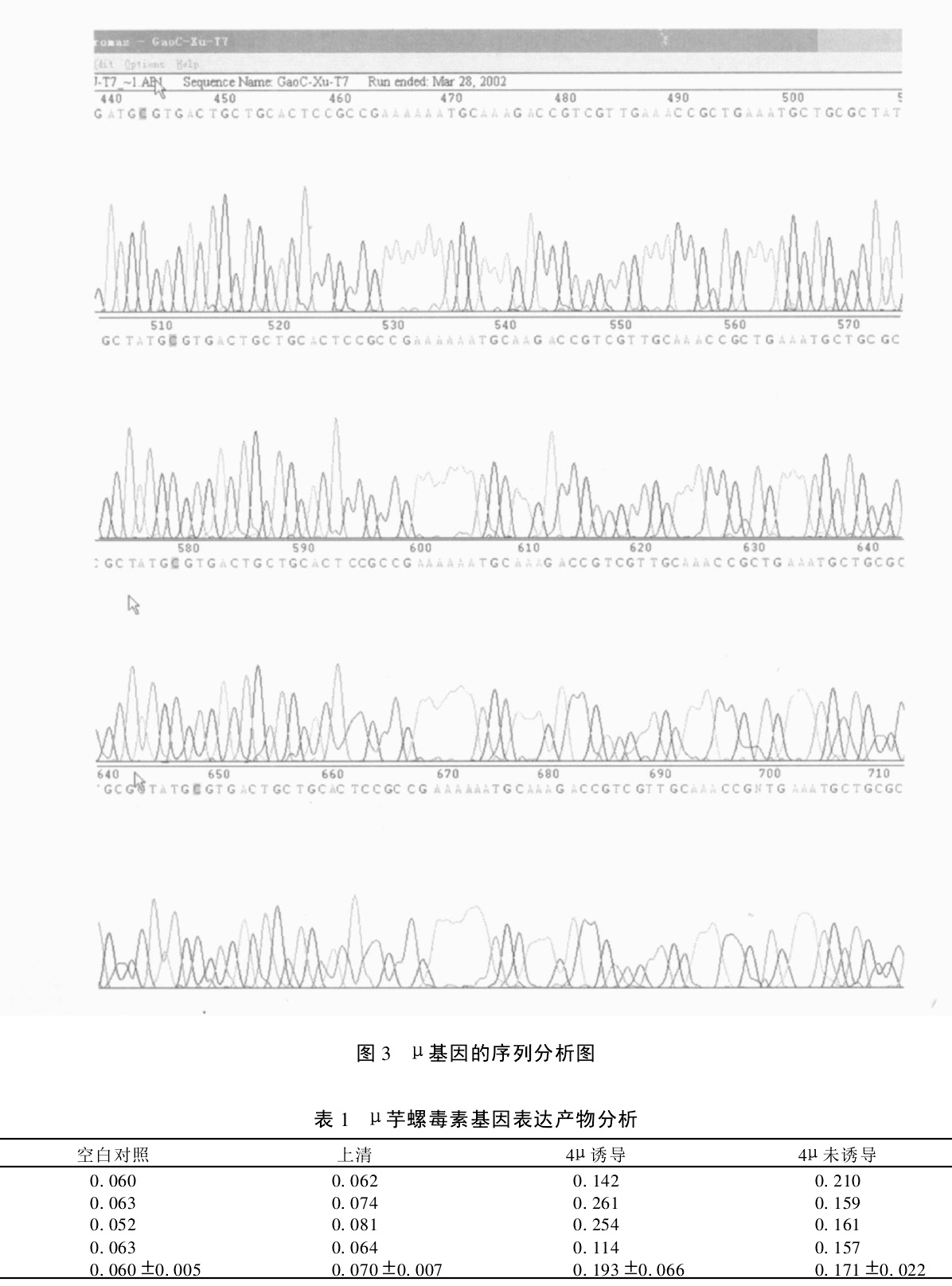 μ芋螺毒素基因序列分析圖
μ芋螺毒素基因序列分析圖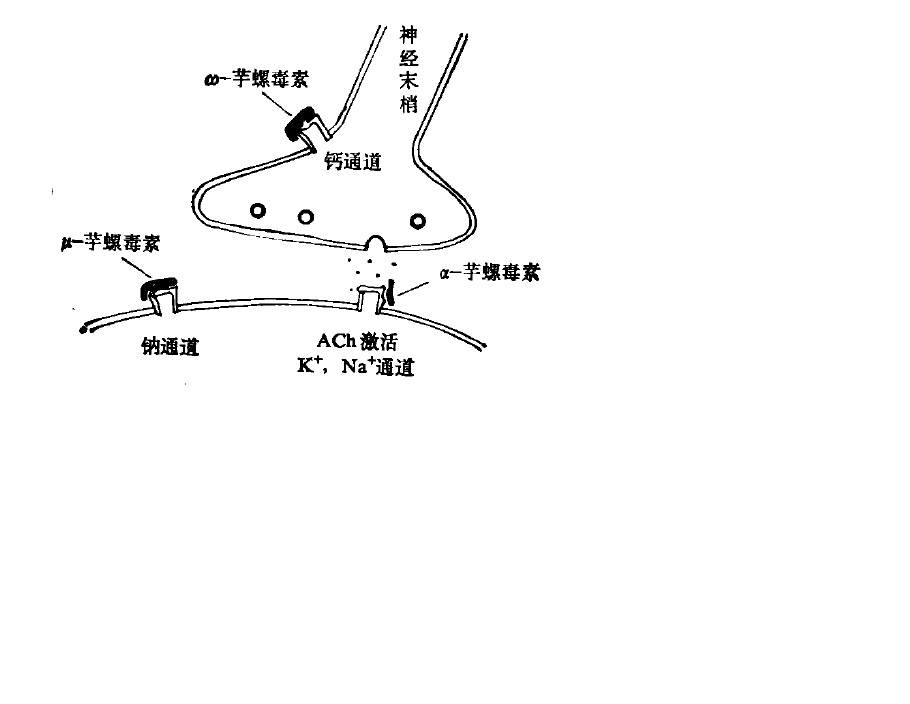 芋螺毒素在肌肉接頭部位作用模擬
芋螺毒素在肌肉接頭部位作用模擬