物化性質,化學結構及性質,分離純化,合成,毒理,毒素分布,毒性,毒素作用機理,檢測方法,生物檢測法,受體結合測定法,化學儀器分析法,鈉離子通道測定法,生物感測器檢測法,免疫學檢測方法,臨床表現及治療,套用,
物化性質
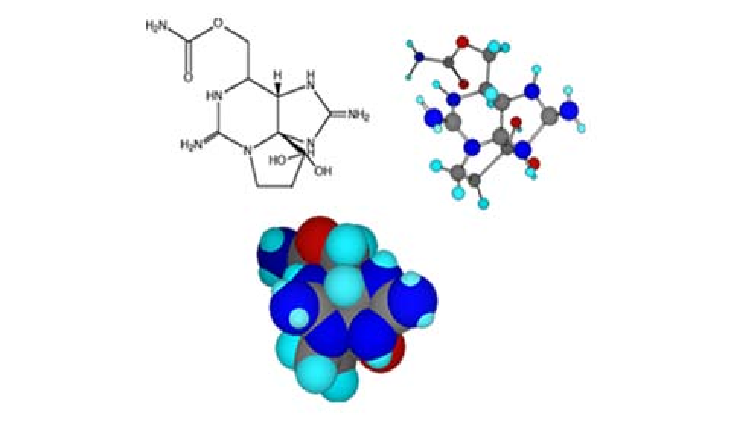
化學結構及性質
STX的化學研究是在1960-1970年間利用鏈膝溝藻培養藻體得到標準品進行的,化學結構於1975年由Schantz 等正式確定,分子式為C
10H
17N
7O
4,分子量299。STX屬海洋胍胺類毒素,是四氫嘌呤的一個衍生物,是絡合有機物的四氫嘌呤衍生物,分子式中氮和氧的原子總數超過碳原子數,7個氮原子中有6個以兩個胍基形式存在。活性部位主要在2個胍胺基和2個羥基。以STX為基本骨架,取代基不同而衍生出來的多種甲氨酯酸類生物鹼化合物的混合體。
 石房蛤毒素異構分子轉化
石房蛤毒素異構分子轉化STX是一類低分子量二代鹽神經性毒素,外觀呈非結晶白色粉末,純品是一種白色、吸濕性很強的固體,易溶於水,微溶於甲醇和乙醇,不溶於非極性溶劑,耐熱,胃腸道易吸收,不被人體消化酶破壞,在高溫和酸性條件溶液中穩定,酸性條件-20℃可保存數年不失活,只有在高濃度酸溶液中才發生氨甲醯酯水解,氧氣也影響其活性。其在鹼性條件下不穩定,可發生氧化反應,毒性消失,較高pH下迅速失活並產生螢光物質,利用這一性質可進行色譜分析。STX有2個滴定基,pKa分別是8.2和11.5,它們之間很容易相互轉化,即毒性低的可轉化為毒性高的。氧氣也會影響其穩定性,使活性降低。由於STX耐高溫和酸性環境,所以通常的烹調加工不能使其破壞,這一點對食品衛生與安全威脅最大。
分離純化
STX等毒素的分離過程與河魨毒素的分離過程基本相同。1975年Schanta等首先從加州貽貝中分離提純STX,中國對於貝類的研究工作較遲,林燕堂、邱德全等分別對大鵬灣海域、廣東沿海麻痹性貝毒及海南三亞海區的腹瀉性貝毒有過研究報導。而試劑公司出售的標準品,是通過提純原生藻類而得到的。蛤的毒素含量遠低貽貝,但有毒蛤比貽貝容易獲得,因而是毒素的主要來源。在蛤中大約有2/3的毒素存在於呼吸器官,在蛤呼吸器官中毒素含量為5000-10000MU/100g或更多一點時才收集(Mu 是小白鼠單位,用1.0 ml含有毒素的水溶液注射到小白鼠的腹腔,一隻體重20g的小白鼠如在10min 後死亡稱為1Mu),貽貝肝或消化腺的毒素要在0.5 MU/mg或多一點時才收集。
實驗表明,多數弱鹼性毒素能夠吸附在Sephadexg-15或Bio-Gel p-2凝膠上,並可以用稀醋酸溶液進行洗脫。雖然弱鹼性毒素在特殊凝膠上的選擇性吸附還沒有確切的理論,但這一發現卻為提純弱鹼性毒素開闢了道路。用羧酸型樹脂Bio-Rex70已經分離純化出10多種STX及其衍生物。一般提取工藝如下:毒性貝或甲藻提取物→脫脂處理→Bio-Gel P-2(pH5.8)→水洗脫→Bio-Gel P-2-N-硫酸鹽GTX(0.03mol/L醋酸洗脫代替水洗脫→粗毒素混合物→Bio-Rex70(H+)→梯度酸洗脫-STX,gTX,neo-STX)。弱鹼性毒素經粗分離後,用羧酸型樹脂Bio-Rex70 的中壓層析進行精分離,以梯度醋酸洗脫緩衝溶液而得到純化的STX等毒素。其毒性為100-500Mu/mg。經過一次純化,可得到2500 Mu/mg或多一點的毒素,然後用Al2O3柱層析,純化得5000Mu/mg的毒素,最後純化可回收15%-30%的毒素,如果把較不純的部分再進行純化,回收率可增至50 %。
中國也開始了PSP毒素提取分離純化研究,通過多柱多級分離純化分級製備。王雲峰通過培養塔瑪亞歷山大藻細胞,提取出PSP粗毒素,利用凝膠過濾和離子交換樹脂分離純化,最終得到-GTX2,3和GTX1,4純品。繆宇平對膝溝藻毒素製備及其測定方法進行了研究,但是中國未見STX分離純化報導。已分離到20種以上的化合物,它們對研究鈉通道作用機制及STX套用具有重要作用。
合成
由於STX和其同系物重要的生物學特性及其獨特的三羥基和二環胍基結構,,每個包含一個四價的縮醛胺離子,這兩個胍胺離子可以模擬Na+。根據其獨特的、高極性的、多原子的結構特徵,已經完成了四種該類生物鹼家族成員的全合成。STX化學合成於1977年首次由Tanino H完成了STX消旋體合成。許多各具獨特生物學特性的STX同系物也已經分離出來。如與STX(1)不同且結構最複雜的zetekitoxinAB(2)是從Panamaniangolden frog Atelopus zeteki中提取出來,在小鼠腦中對鈉離子顯示出極高親和力。Oshima Y等從澳大利亞雙貝殼裸甲藻分離出decarbamoyloxysaxitoxin(3,doSTX)。Strichartz等報導了外消旋體3的合成,但天然毒素的旋光性還不清楚。Fleming JJ等先後報導了(+)-saxitoxin(STX)的不對稱合成STX的第一和第二代合成。Iwamoto O等報導了decarbamoy loxysaxitoxin(3,doSTX)的對映選擇性全合成。通過17個步驟從旋光性氧化氰9以10%的產率獲得了具有推測的天然產物對應體。隨後,Iwamoto O 等又報導了利用一種全新策略進行(-)-and(+)-decarbamoy loxysaxi-toxin and(+)-saxitoxin 1全合成。此方法是基於利用IBX對C4位氧化,通過α-iminium羰基媒介和胍基在C5 位酸促成環作用,利用1,3-偶極環化加成和一個獨特的IBX氧化反應完成了(+)-STX的全合成,該方法提供了一種有效的二元胺媒介合成STXs關鍵。他還依靠包括一個STX中間產物的差異方法和一個新研發的胍基環狀結構方法學,成功完成了(+)-dcSTX和(+)-GTX3 的全合成。STX及其同系物的全合成為其套用研究奠定了良好基礎。
毒理
毒素分布
STX最初來源於某些有毒海洋藻類,主要是甲藻屬(dinoflagellattattegenus)的一些藻類,包括鏈膝溝藻(Gonyaulax catenella)、塔駝原膝溝藻(Protogonyaulax tamarensis)、亞歷山大藻(Alexandrium catenella)、微小亞歷山大藻(Alexandrium minutum)等。某些淡水藻類也可以產生STX,如淡水藍藻(Cylindrosper mopsisraciborrskii),某些細菌和紅藻中也產生這類毒素,但尚未最後確證。已確定的產毒最高的物種是溝鞭藻類,是赤潮的致病微生物。此外,在淡水和海水河魨魚、兩棲類動物(斑蟾)、紅藻類和從甲藻細胞中分離出來的細菌。這些藻類產生的毒素,通過食物鏈蓄積於濾食性貝類、魚、蝦、蟹等水產品中,如貽貝、石房蛤、扇貝、鯖魚、花紋愛潔蟹等。不同有毒藻所產生的毒素種類和含量不同,而同一種有毒藻產生的毒素種類和含量在生物不同生長階段也不同,同時毒素產生狀況還受到生物因素(如細菌)和非生物因素(如光照、溫度、營養鹽等)影響。並且毒素可以向更高一級的捕食者傳遞。通過生物富集水生食物鏈,傳給陸地生物群,最後到人類。
世界各地都有包括石房蛤毒素在內的麻痹性貝類毒素分布,尤其是歐洲及北美一些國家。在世界各地水體中檢測到毒素及中毒報導較多,中國東南沿海一帶地區也經常發生食用有毒蛤類、螺類、貝類引發人中毒事件。STX通過非傳統的(非濾食性生物)載體而引起人中毒已經得到證實,包括腹足動物、食肉動物、草食動物、甲殼類、魚類等,監控和管理這些非傳統載體,防止STX中毒具有重大意義。
毒性
石房蛤毒素的毒性包括神經系統、心血管系統和細胞毒活性3 個方面。STX是毒性最強的神經毒素之一,是典型的鈉離子通道阻滯劑,通過阻滯Na+通過膜進入細胞內,使膜失去極化狀態,從而阻斷神經肌肉的傳導。STX及天然衍生物所構成的PSP有很高的致死率,STX對成年人輕度中毒量為110μg,致死劑量為540-1000μg,STX和neoSTX毒性最高,LD50為9μg/kg(小鼠,ip.),其毒性是氰化鈉的1000倍以上,是眼鏡蛇毒性的80 倍。然而,由於每種衍生物對電壓門控Na+通道受體具有不同的親和力,因此這類毒素的毒性也不同,其中neoSTX的毒性僅次於STX。
中國已將STX毒素列為貝類產品常規檢測指標之一。STX對呼吸和心血管功能均有抑制作用,對呼吸和心率抑制快速而持久,對血壓抑制輕,作用時間短;STX可通過血腦屏障到達肝、腎和中樞神經;10μg/kg(ip)導致小鼠呼吸停止,心臟血管功能損害是致命的,毒素在小鼠體內不能代謝。
STX主要作用於突觸前膜,與膜表面毒素受體結合,阻斷突觸後膜的Na+通道,產生持續性去極化作用,特異性的干擾神經肌肉的傳導過程使隨意肌鬆弛麻痹,導致一系列的中毒症狀。STX在很低的濃度下(3×10-7mol/L)即可阻斷Na+通道,而對K+通道則毫無影響。STX不影響突觸前神經末梢傳導介質的釋放。STX對膽鹼酯酶有抑制作用,對Na+、Ca2+、K+通道均有調控作用,已經成為尋找防治心血管疾病藥物的重要來源。PSP 類毒素具有鈉離子通道阻斷劑特性,可拮抗箭毒、藜蘆鹼的作用,以減少或“解救”細胞形態的改變及細胞裂解死亡,而且此拮抗或“解救”作用與PSP類毒素的量呈劑量-反應關係,根據此原理可以套用細胞毒性試驗檢測石房蛤毒素等麻痹性貝毒素。
毒素作用機理
STX毒素屬於胍類毒素,其活性部位為7、8、9位的胍基,與可興奮細胞膜上的電壓門控Na+通道位點1的胺基酸殘基高親和,通過選擇性阻斷Na+內流,阻礙動作電位的形成而起抑制作用。由於神經Na+通道、腦Na+通道、心Na+通道、骨骼肌Na+通道等各種Na+存在差別,STX的7、8、9 位的胍基與Na+通道胺基酸殘基的結合也有所不同,但都是與更靠近Na+通道外口的胺基酸殘基結合。在成年兔骨骼肌Na+通道中,STX通過7、8、9位的胍基與通道上的Asp400和Glu755高親和;此外,STX的C-12位的羥基(作為水合酮)和氨甲醯基側鏈官能團對通道阻斷也起一定作用,但不是關鍵性作用;STX1、2、3位的胍基與通道上的Asp1532親和,也增加了其對Na+通道的阻斷作用;而neoSTX在N1位比STX多了一個羥基,該羥基能夠與Asp400和Tyr401作用,可與Tyr401形成氫鍵,因此比STX有更高的親和力。
STX可阻斷可興奮細胞電壓依賴性門控通道,對鈉離子通道具有高親和性。由於心房肌和心室肌屬於快反應細胞,其特點是細胞的興奮由鈉離子快速內流引起。在STX的作用下,鈉通道被阻斷,心房和心室肌收縮因此下降。心房和心室肌對STX的敏感性有所不同。心房肌的敏感性較心室肌對STX的敏感性要低,在能完全阻斷心室肌的STX劑量,心房肌節律雖有所減慢,但仍能維持,表明心房肌和心室肌鈉通道的類型可能有所不同。心室收縮能力下降並不是心肌本身的收縮特性受到影響,因為在心室收縮完全阻斷的情況下,心肌條仍可對2倍閾強度的電刺激起反應,這表明心臟傳導阻滯主要發生在心房與心室之間的傳導組織,其次在心肌細胞之間。研究表明STX僅作用於鈉通道的外表面,但並不改變通道的門控行為。由於在STX作用下,心臟傳導隨劑量增加逐漸阻斷,參與興奮與收縮反應的肌纖維逐漸減少,故心肌收縮不斷減弱,但心肌降至一定幅度時不再下降,因為與電極接觸的那部分心室肌纖維直接接受外界電刺激發生興奮和收縮反應,故心肌條收縮幅度不再發生變化。由於在STX作用下,心臟傳導被阻斷,外周血壓因失去原動力而下降,這可能是外周血壓下降的主要原因。由於STX與Na+通道受體具有很高的親和力(1-10nmol/L)和特異性,因此,在低毒素濃度下(3×10-7mol/L),即可與Na+通道受體結合,進而產生高毒性作用。宋蔚忠等報導了STX對大鼠心血管和呼吸功能的影響,結果表明:STX對呼吸功能和心血管功能均起抑制作用,並且作用迅速,很快就能達到高峰,其中對呼吸和心率抑制快速而持久,對血壓抑制輕,作用時間短。劉潔生等報導了石房蛤毒素的外周降壓作用,結果表明:0.4 MU/kgSTX即對鰻魚外周血壓有明顯的降低作用。Andrinolo D等對STX毒理進行了探討,用貓做實驗動物,靜脈注射劑量10μg/kg,出現血壓下降,心肌衰竭,心臟停搏等症狀,證明STX可通過血腦屏障,到達肝、腎和中樞神經。
 毒素對日本鰻魚心臟影響示意圖
毒素對日本鰻魚心臟影響示意圖STX是重要神經毒素、Na+離子通道阻斷劑,也是大多應激細胞去極化和轉導關鍵因素,它還是其他受體蛋白如鈣離子、鉀離子通道,是轉鐵家族成員之一。STX作用機理與河魨毒素(Tetrodotoxin,TTX)基本相同,但化學結構不同,可能不是作用於同一受體。STX通過與神經及肌膜上鈉離子通道蛋白上的受體結合,結合部位是位點Ⅰ,主要作用於突觸前膜,與膜表面毒素受體結合,該受體位於可興奮細胞膜外側表面,鈉通道外口附近。毒素與受體結合後,阻滯Na+內流,不能引起膜去極化和動作電位的產生,產生持續性去極化作用,從而阻斷離子通道,阻滯神經衝動的傳導和肌肉收縮所需的動作電位傳播,特異性干擾神經肌肉傳導過程,使隨意肌鬆弛麻痹,進而導致一系列中毒症狀。STX與Na+通道結合具有高度的親和力(1-10nmol/L),在很低的濃度下(3×10-7mol/L)即可阻斷Na+通道,因此表現出高毒性,而對K+通道則毫無影響。STX不影響突觸前神經末梢傳導介質釋放。各衍生物的毒性大小與其結合Na+離子通道位點Ⅰ的牢固程度密切相關。一直以來,STX以其與其藥理學受體的高親和性和選擇性而著稱,而且一直認為電壓開啟Na+通道是其唯一作用通道。然而,研究發現,STX是一種多受體靶位的海洋生物毒素,除了Na+通道外,STX也結合Ca2+、K+通道,煙胺比林一氧化氮合成酶,STX代謝酶和2種循環流蛋白,即一種運鐵蛋白和一種獨特的血流蛋白。Sapse AM等研究表明,Na+通道被STX抑制的原因是從通道外膜胍基和羧基相互作用而不能結合Na+離子。此外,STX的C-12位的羥基和氨甲醯基側鏈官能團對通道阻斷也起一定作用,但不是關鍵性作用;STX1位胍基與通道上Asp1532親和,也增加了其對Na+通道的阻斷作用;而neo-STX在N1位比STX多了一個羥基,該羥基能與Asp400和Tyr401作用,可與Tyr401形成氫鍵,因此比STX有更高的親和力。
檢測方法
在食品衛生和安全方面,隨著海洋環境的惡化,赤潮的大量發生,世界對貝毒的檢驗更加重視。美國從1925年就建立了貝毒監測制度,1958年以後,貝產地STX允許量為80μg/100g(相當於400MU/100g)。日本、加拿大等都有類似的規定。飲水中的STX及類似物含量健康警戒線為3μg/L。
生物檢測法包括:(1)生物毒性試驗法。小鼠生物法是AOAC推廣的檢測麻痹性貝類毒素的標準方法,是國際上都能接受的唯一的方法。該方法在檢測樣本總毒性方面相當成功,但是無法準確定性樣本中單個毒素。此外,還有家蠅生物分析法、蝗蟲生物分析法。上述3種生物分析技術原理相似。(2)細胞毒性試驗法。石房蛤毒素具有Na+通道阻滯劑的特性,可拮抗箭毒、藜蘆鹼的作用,以減少或“解救”細胞形態的改變及細胞裂解死亡,且該拮抗或“解救”作用與毒素的量呈對應關係。根據該對應關係可以計算出毒素的含量。早期建立的方法是用顯微鏡計數活細胞數以檢測PSP毒素的量,但試驗時間長,操作繁瑣,所需細胞量大。在該原理之上發展起來一種STX的快速診斷裝置MIST,已成功用於酸性粗毒中PSP總毒性的測定及STX、neoSTX、GTX和dcSTX相關毒性的測定,該裝置的靈敏度高,檢測迅速且無需組織培養的設備及專業知識。(3)免疫分析技術。隨著抗STX抗體的獲得,免疫分析技術如血球凝聚反應、放射免疫分析(RIA)和酶聯免疫分析(ELISA)等逐漸發展起來,其中直接競爭ELISA法是最常用的一種方法,檢測限可達3pg/ml,間接ELISA的檢測限也可達到10pg/ml。免疫方法靈敏度高,方便迅速,但抗體的獲得是其關鍵,各毒素的交叉反應低,不能完全體現樣品的毒性來源。(4)受體分析法。即固相受體結合法(solid-phase receptor binding assay),主要是根據PSP毒素能與Na+通道蛋白質結合的特點,套用同位素標記以檢測PSP類毒素的量,具有快速、可靠、準確的特點。Llewellyn等以一種特異結合STX的類似轉鐵蛋白Saxiphilin代替Na+通道蛋白質,其對STX的鑑定具有專一性,從而與
TTX的鑑定相區別。
儀器測定法包括(1)
HPLC法及其聯用技術。HPLC 法靈敏度高,專一性強,檢出限量低,分析時間短,能夠提供更多的毒素信息,是毒素檢測的主要手段。但石房蛤毒素分子本身的生色基團很微弱,不易被檢測,因而檢測前要將其氧化成螢光生色團,用螢光檢測器進行檢測。氧化手段主要有柱前氧化和柱後氧化,柱後氧化在分離柱後另加的一個柱上進行,簡化了操作步驟。隨著質譜技術的發展,液質聯用技術成為物質鑑定的一個強有力手段。(2)
薄層色譜法(TLC)。TLC法是檢測PSP毒素的傳統方法之一,使用已較少。但新的檢測設備的出現為其發展提供了新的空間。I在層析柱上對STX及其同系物進行棒狀薄層層析分離,以火焰熱離子檢測器(FTID)進行檢測,結果STX的檢出限為5ng,其餘同系物的檢出限也均達到ng級。另外,
氣相色譜、離子交換柱層析、
電泳法等均是檢測STX毒素的傳統技術,方法優劣各異。
生物檢測法
小鼠生物測定法(mouse bioassay,MBA)是在STX得到鑑定之前就已經研究出來的檢測方法,並且其它的檢測方法都以該方法作為參照。MBA用於檢測STX已經有很長的歷史,是AOAC於1958年確認的法定檢測方法。大部分國家依然在使用該方法。該方法技術上簡單易行且不需特殊設備。鼠類的神經細胞對STX的反應與人類神經細胞的反應一樣,因此,該方法的測定結果直接關係到人類健康的風險評估。多數國家規定海洋貝類產品中STX可接受的最大含量為80μg STXeq/100g,墨西哥控制在30μg STXeq/100g,菲律賓控制在40μg STX eq/100g。但也有人認為80μg STXeq/100g的檢測限可以保證人類的健康不受威脅。這類毒素在飲用水中的含量規定也不同。1999年研究人員等通過實驗計算出了飲用水中PSTs可接受的最大含量為3μg STXeq/L。後來,澳大利亞將這個濃度套用到了飲用水標準中,巴西將其定為強制性的法規標準,紐西蘭將這個濃度定為飲用水中可接受的最大含量。但是,MBA對該濃度的敏感度不夠,樣品不經過濃縮很難檢測出來。MBA的最低檢測限為40μg STXeq/100g,相當於0.2μg/mLSTX,或200μg/L STX。因此,儘管MBA一直被廣泛套用於檢測經生物富集作用而STX含量高的海產品中,卻不適用於飲用水中STX含量的檢測,同時無法準確定性樣本中單個毒素,而且實驗動物檢測方法在某些地區已經被禁止。針對存在的這些問題,逐漸研究出一些新的檢測貝毒的方法,如化學、生物化學、毒性測定等方法,同時也可用於檢測淡水藍藻和被污染的水源。
運用細胞生物測定法來檢測PSTs含量的方法已經建立,並且可以代替MBA進行毒性檢測,該方法專門用於檢測像STX這類可以阻斷電壓門控Na+通道的毒素。神經瘤細胞測定是在神經細胞內的Na+通道水平上檢測PSTs。STX是一種Na+通道阻斷劑,其功能是可以通過與打開鈉通道的藜蘆定的拮抗作用檢測出來。最初建立的細胞生物測定法是通過鼠神經母細胞瘤的形態學作為端點來評估測定結果,隨後Jellet和Manger對這種方法進行了改進,採用色度法顯示有更好的選擇性。因此,如果實驗室能承擔得起基於MS的檢測方法的儀器費用,那么這種檢測方法在將來很可能會代替STX的色譜分析。
受體結合測定法
通過末點來測定細胞的活力,從而使其更便於自動控制。在這種測定方法中,神經瘤細胞培養於96孔細胞培養板中,用Na+通道激活劑藜蘆定處理,增強Na+以及Na+/K+-ATP酶抑制劑烏本甙的內流,從而阻斷Na+外流。在PSTs的存在下,通過使用MTT(3-[4,5-二苯基-2羥基]-2,5-二苯基四唑來測定細胞活力。通過使用標準量的藜蘆定和烏本甙,細胞受保護的程度可以通過與PSTs的標準量對比,以此來定量PSTs的總量,然後結果轉換成STX當量。鼠和人的成神經瘤細胞都可以用於該測定方法。
Saxiphilin是一種結構與轉鐵蛋白相似的蛋白,研究表明,其與PSTs有很高的親和力。然而,不同的Saxiphilin對不同的類似物有不同的親和力。到為止,從熱帶蜈蚣(Ethmostigmus rubripes)體內分離的Saxiphilin在試驗中有最小的選擇性。利用這一特性,Llewellyn LE等建立了檢測PSTs的特異受體法,該方法的檢測限為6.3μg STXeq/L,或1.3μg STXeq/100g貝肉。但研究人員聲明,在沒有額外的基質干擾下,如果增大樣本容量,該方法的檢測限會降低。從熱帶蜈蚣體內提取粗Saxiphilin的程式很簡單,製備的產物很穩定,可以反覆凍融,在-80℃下可以保存一年以上。編碼Saxiphilin蛋白的基因克隆,以及文庫的構建已經完成,可以通過真核表達系統表達該蛋白,並且得到的表達產物具有生物活性。更進一步的研究證明,同時採用SCBA 和Saxiphilin受體檢測法檢測介蟲和貝類體內的非PSTs鈉離子通道活性,其實用性很好,因為非PSTs如河魨毒素(TTX)不與Saxiphilin結合,而且檢測結果與HPLC和MBA的結果有很好的相關性。
該方法最初是用來監測貝類和魚類產品中的海洋毒素,並且在檢測海洋神經毒素類方面得到了很好的驗證。其他的研究人員也運用此法檢測在淡水藍藻細菌中占優勢的PSTs的衍生物,進一步對該法進行了的驗證。研究表明,神經細胞瘤生物測定法得出的結果與鼠生物法測定的結果很接近(相關係數R2=0.96),而且有敏感性更高的的優點,其檢測限為10ng STXeq/mL提取物(相當於2.0μg STXeq/100g 貝肉)。通過細胞生物測定法獲得的結果與色譜法得到的結果也有很好的相關性。然而,生物測定法有其獨特的優點,即對任何可以抑制Na+通道的毒素,無論是已知的PSTs類似物,還是未知的變異體,都有很好的敏感性。正如Humpage 等所描述,該測定方法可以檢測未定性的、不能被色譜法檢測出來的很多毒素。細胞生物測定法不能區分相似的毒素,只能提供一個所有毒素的累積效應值,因此與MBA相比,在細胞培養測定中該方法很難確定相關毒素類似物的毒性反應,除非將每個類似物進行單個的分析。然而,Llewellyn等提供的相關數據表明,當使用複雜的PSTs混合物時,細胞生物測定法與MBA相比是一個很好的毒性預測器。Llewellyn等還同時使用MBA、細胞培養測定、HPLC和放射性受體測定對含有複雜的PSTs的21種貝肉提取物進行了分析,在這四種檢測技術中,與MBA相關的細胞培養測定法的測定結果與預期的毒性最接近。但是,細胞生物測定法依然存在一些缺點。首先,由於該方法依賴藜蘆定和烏本甙的拮抗作用,必須使用適當的濃聚物以使其與PSTs反應敏感。正如Jellet等所討論的,任何毒素濃聚物濃度的改變都會降低該方法對PSTs檢測的敏感性。其次,該方法的標準檢測裝置運行慢,需要很長的細胞孵育時間(24-48 h),才能對成神經瘤細胞形成細胞毒性作用。
化學儀器分析法
HPLC 被廣泛用於有機化合物的分離,同時也是第一種用於檢測PSTs的儀器分析方法。然而,該技術也存在一些缺點,首先需要毒素標準品作參照,其次缺少用來製備螢光產物的光反應酶或後置柱衍生物化法的載色體,尤其是在樣品製備過程中PSTs可能會發生化學轉化。這種轉化經常會使低毒的毒素變成毒性強的毒素,導致無法確定原始樣品中毒素的真實毒性。因此,毒素的變異促使檢測方法也不斷發展,促進更精確的抽提和分離方法的發展。最早的STX理化檢測方法是由Bates和Rapoport提出的,由於缺乏STX的載色體,這種方法只能在鹼性環境下,將STX用過氧化氫氧化成螢光化合物以達到檢測的目的。那時,人們認為這種方法的敏感度比鼠生物法的要高,並且建議用這種方法來進行貝類樣品的常規檢測。然而,這種方法操作很複雜,使用好幾種溶劑和10步以上的化學過程。他們對這種方法進行了改進,增加了精確度和可重複性,但這種方法的操作依然很複雜。
在20世紀80年代,許多研究機構使用諸如X射線衍射、薄層色譜-螢光檢測、高速液相色譜(HSLC)等方法發現了新的化合物。1975年,Shimizu等第一次描述了gTX1、GTX2、和gTX3的存在。使用葡聚糖凝膠g或生物膠P-2聚丙烯醯胺凝膠柱,通過稀乙酸洗脫,從gTX成分里分離出了STX,然後使用HSLC將gTX的峰值分解成三種不同的毒素。1987年,Oshima和他的合作者開發了一種後置柱氧化法,該方法可以詳細地分析天然甲藻、水華、貽貝、牡蠣等抽提物中所含的PSTs。與Oshima的後置柱氧化法相反,Lawrence等研製了使用前置柱氧化的液相色譜法,來產生帶螢光的PSTs衍生物。他們證明,使用過氧化氫氧化對分析非羥基化毒素的敏感性更強,而高碘酸鹽氧化作用對分析羥基化毒素的敏感性更強。在這一時期,他們改進了這種技術,例如向高碘酸鹽氧化劑中添加了銨甲酸鹽,從而改善了neoSTX、GTX1、B2和C3的分析結果,而且由於添加了這種化合物到流動相,使neoSTX和B2的色譜分析更好。由於在檢測過程中,pH對檢測結果的影響很大,研究人員在檢測過程中對pH進行了控制。Gago-Martinez等使用前置柱方法時,分別將高碘酸鹽和過氧化物氧化過程的pH調節到7.2-12和8.2-12.8,最後得到的螢光氧化產物的產量不同。當pH在8.2時,通過高碘酸鹽氧化作用neoSTX的產量達到了最大,而pH在10-11.5時,STX、GTX2/3、dcSTX和gTX5的產量也都達到了最大。Lawrence等聲明採用柱前氧化pH很容易控制,因此結果的可重複性更強,因為在後置柱氧化時pH變化很小,相應對標記上螢光的產物的產量影響很小。然而,儘管柱前方法相對比較簡單,但是一些PSTs形成了相同的氧化產物,另外一些形成了不只一種螢光產物。這種方法被建議作為一種篩選方法來為監測程式服務。最初的提議是首先使用高碘酸鹽氧化方法,當檢測出大多數PSTs,並且毒素濃度超過常規檢測限80μg STXeq/100g時,接著採用過氧化氫氧化。色譜氧化法已經用於檢測貝類中的毒素,研究PSTs在不同地區鼠腦的分布,他們認為這種方法很合適,敏感度也很高,因此該方法已被歐洲國家確定為檢測PSTs的官方檢測方法之一。然而,Ben-Gigirey等進行了實驗室研究,推斷儘管該方法適合於檢測研究,但對含有更複雜毒素的樣品進行分析時,得到的結果不理想,並且也不是對所有的PSTs都有效。此外,該法只是針對STX、GTX2/3、dcSTX、dcGTX2/3等毒素類似物,可以得到滿意的檢測結果。Turner等使用該標準對Lawrence的方法進行了進一步的驗證,主要包括其選擇性、線性、檢測限、準確性、回收率、精確度、可重複性、適用性,同時也包括添加dcNeoSTX、dcGTX2/3等PSTs。Turner等對該方法進行了改進,以增加氧化產物的穩定性,改善了固相離子交換的純度,最終推斷該方法可以得到滿意的結果。
液相色譜-質譜聯用法(Liquid chromatography–mass spectrometry,LC-MS)是一種有效的檢測技術,可以用來鑑定未知的化合物,定量已知的物質,闡明新分子的化學性質和結構,實現檢測的高敏感度、可選擇性、精確定量和高通量。然而,LC-MS價格昂貴,需要有專業知識的技術人員操作和維護。儘管如此,Quilliam建議將LC-MS檢測方法作為檢測海洋毒素的普遍方法。MS檢測PSTs面臨的挑戰之一是離子配對劑對目標化合物的離子化產生干擾,因此離子配對劑要對PSTs有高效的反相色譜。因此,Jaime等研製了一種色譜方法,該方法使用基於非離子配對洗脫和後置柱電化學氧化的陰陽離子串聯交換柱。Dell’Aversano等開發了一種實用的親水性液相色譜法,該方法不僅可以分離主要的PSTs,而且還可以分離藍藻細菌中的甲醛類毒素、柱孢藻毒素等。採用該方法,在質譜儀運行選擇性反應監控程式時,檢測出了15種PSTs,並鑑定出了新的毒素類似物。Diener及其合作者使用兩性離子親水作用色譜法分別與MS和螢光檢測聯用,在單個梯度下來檢測PSTs,他們推斷這兩種方法都可以得到可靠的定量結果,能夠很好的分離更多相關的PSTs。這兩種檢測方法的檢測限只有微小的不同,螢光檢測儀有更好的敏感性,而MS檢測儀在更短的運行時receptor-binding assay,RBA)、免疫學分析技術等。隨著科學技術的發展,又出現了一些新的研究方法套用於檢測STX及其類似物,例如生物感測器法、色譜-質譜連用法、螢光定量PCR等方法。
鈉離子通道測定法
Vieytes等公布了一種快速、敏感度高的鼠腦鈉離子通道方法。實驗中分離了15-40個鼠腦用來製備鈉離子通道含量為5.8±0.06 pmol/L的溶液,該溶液在-80℃條件下,至少可以保存30d。鈉通道吸附在96孔培養板的板底,然後加入含有3H-STX的溶液,鈉通道會與3H-STX結合。將未結合的3H-STX洗掉,並對結合上的毒素進行閃爍計數以定量。但研究人員發現,儘管用牛血清白蛋白(BSA)封閉板孔來阻止非特異性結合,但通過放射性檢測依然有21%的非特異性結合。然而,儘管有相對較高的背景,使用未標記的和3H 標記的STX所做的競爭實驗得到的IC50值為1.7ng STX/mL。用粗的含有PSTs混合物的貽貝提取物所做的實驗顯示,其結果與MBA和HPLC的結果有很好的相關性。根據其精確度判斷,可以作為一種典型的檢測方法,並且在幾小時內就可以得出結果。Doucette 等改進了這一方法,使其實現了相對高通量的形式,而且採取更大樣本容量的檢測驗證了這一點。製備的鈉通道在-80℃條件下,可以穩定保存至少6個月。他們也提供了更寬泛的QA/QC標準,來解釋測定結果。Doucette等給出了一個競爭結合3H-STX和未標記STX的抑制常數(Ki)3.66 nmol/L,和樣品提取物LOD 的估計值5 ng STX/mL。檢測分析了26個貝類樣本和20個浮游植物樣本,證明該方法的測定結果與HPLC和MBA測定的STX毒性當量的摩爾數有著合理的相關性。鈉離子通道結合測定方法(The sodium channel-bindingassay,SCBA)測定的浮游植物和貝類樣品提取物的毒性,略高於HPLC和MBA的測定結果。Ruberu等對該方法進行了改良,從而使其在不同的實驗室使用不同的閃爍計數器可以得到準確且精確的結果,並對儀器的操作程式進行了最佳化。SCBA也存在一些缺點,例如,該方法依賴放射性標記的STX和非標準化鈉通道的製備,尤其是製備的鈉通道的活性及其保存時間對檢測產生很大的影響。
生物感測器檢測法
有關生物感測器用於檢測PSTs的報導很少。很多研究人員都試圖通過將鼠腦Na+通道、抗PSTs的抗體或Saxiphilin蛋白吸附於表面等離激元檢測晶片上建立生物感測器方法。該技術主要是檢測與配體結合到一個固定在感測器晶片上的大分子相關的分子構象的改變。雖然該方法處於研究初期,卻為檢測方法的研究帶來了新的希望,尤其是使用抗體作為感測分子來檢測目標物。然而,檢測限依然不足以檢測飲用水中的PSTs。而且,當抗體用作感測分子時,相同的關於限制ELISA實用性的交叉反應問題也出現在了該技術中。用Na+通道做成的組織感測器在測定淡水藻類中的STX時非常敏感,用蛙氣囊膜做成的生物感測器,可以測量非常微量的STX。
免疫學檢測方法
由於ELISA方法具有敏感、快速、操作簡便的優點,已經廣泛用於檢測中,尤其是醫學和食品檢測領域。該技術所面臨的挑戰是檢測像PSTs這樣的多種相關化合物的混合物時,需要保持其識別靶物質結構多樣性的能力,同時忽略複雜的基質中其它化合物的影響,對此Usleber等概述了建立抗體檢測技術的研究進展。研究顯示,抗STX的抗體與neoSTX有很弱的交叉反應,而且這種選擇性可以套用於該家族的所有類似物。Chu 等研究發現基於抗STX抗體和抗neoSTX抗體的測定之間有很弱的相關關係,結合這兩種測定結果,檢出率雖然得到了改善,但是依然不高,只有MBA的80-85%,陽性結果較低。Kawatsu等建立了針對gTX2/3的單克隆抗體,以完善先前建立的針對STX和neoSTX的抗體。該抗體保持著與STX/neoSTX家族其它抗體的差別,但是和gTX2/3、dcGTX2/3、C1/2有著很相似的親和力。Garthwaite等對多重檢測方法進行了深入的研究,並建議使用一整套的ELISA,不僅檢測貝類樣品中的PSTs,也檢測遺忘性貝類毒素、腹瀉性貝類毒素和神經毒性貝類毒素。螢光定量PCR法Al-Tebrineh J等建立了一種SYBRgreen的特殊定量PCR 方法,來定量檢測魚腥藻屬藍藻細菌產生的STX。該方法主要是通過確定藍藻細菌中已鑑定的STX基因簇中獨特的多聚乙醯序列拷貝數來推斷樣品產毒性的能力。Al-Tebrineh J等使用這種方法檢測了從澳大利亞不同地方的湖泊、水庫、河流中採集的水樣,通過HPLC和顯微細胞計數確定了水華中STX的富集和藍藻細菌細胞密度。通過實驗證實,STX富集確實與STX基因拷貝數相關,這就表示後者可以作為一種測量魚腥藻屬和其它水華藍藻細菌的產毒潛能的方法。定量PCR 方法的靶向STX基因也可以用於水華魚腥藻屬和其它幾種藍藻細菌產STX的能力的監測和生態生理學研究。
臨床表現及治療
人類多因誤食含STX的貝類等海產品而發生中毒,中毒症狀往往因食入的量不同而不同。輕度中毒表現為噁心、嘔吐、腹瀉,局部皮膚有麻或刺痛感。重度中毒後,表現為神經肌肉麻痹,隨意肌無力,呼吸肌收縮無力,血壓下降,心率減慢,心律失常,患者多感到身體有漂浮感,嚴重中毒15 min內就可死亡,STX中毒的死亡率約為10%左右。對STX中毒沒有特效藥,臨床上主要是採取催吐、洗胃,用活性炭吸附胃內的毒素。4-氨基吡啶可以拮抗STX的毒性作用,起到治療效果,但4-氨基吡啶毒副作用大,安全劑量範圍小。因此,4-氨基吡啶對STX中毒的治療效果和安全劑量範圍有待進一步研究。
石房蛤毒素中毒死亡率高,無特異性解毒藥,主要是對症支持治療。中毒病人在常規治療的基礎上主要採用了以下三項措施(1)維持體內弱鹼性內環境,依據血氣檢測結果,用5%碳酸氫鈉溶液靜脈滴注,維持血氣pH7.40-7.45、HCO3-24-27mmol/L至患者出現表淺自主呼吸運動為止。(2)換血療法,是中毒的重要治療措施之一,能迅速降低血液毒素濃度,促進機體代謝,促進解毒,較安全。(3)中藥湯劑灌服,中醫認為動物毒中毒屬邪毒,主要以清熱解毒為治法,復《景岳全書》:“紫蘇葉,味辛、氣溫……解魚蟹毒,治蛇犬傷……”。用紫蘇葉20g加生甘草10g煎至150ml經胃管灌服應有利於解毒。
套用
STX在赤潮檢測、分子生物學、神經生物學、醫學診斷、藥物開發、軍事戰劑等研究中都有套用。在醫學診斷與藥物開發方面,STX獨特的化學結構和毒理作用機制,在研究平滑肌和心肌離子流、Na+通道結構、化學藥物對神經肌肉傳導的影響等方面,使它成為研究Na+通道的重要工具藥。PSP 的鎮痛、麻醉、解痙、止喘以及作為抗癌藥物方面已經開始探索。STX具有顯著的抗腫瘤、抗病毒活性,對癌細胞的破壞性相當高。STX具有較強的降壓作用,2.0-3.0μg/kg可降低狗和貓正常動脈血壓的2/3,劑量大於1.5μg/kg時可能阻滯血管神經而減小外周阻力;劑量大於1.5μg/kg時則直接弛緩血管肌肉而達到降壓目的。STX有局麻作用比普魯卡因強10萬倍。
STX長期以來為軍事實驗室所套用。據稱,它不能與用於大量分布的神經毒劑相比,但作為一種毒彈裝備較為有價值。用來福槍射出STX到人體,僅感覺與蚊子咬痛相仿,但不到15min即死亡,比細菌毒素引起的死亡時間短很多。STX是一種快速毒素,中毒後症狀在0.25-4.00 h發作,STX是強烈的膽鹼酯酶抑制劑,對中樞和外神經均有強烈的作用;它對中樞的作用主要是對心血管和呼吸中樞的作用,它能妨礙離子的通透,從而擾亂神經-肌肉的傳導。
 石房蛤毒素異構分子轉化
石房蛤毒素異構分子轉化 毒素對日本鰻魚心臟影響示意圖
毒素對日本鰻魚心臟影響示意圖