雙脫氧鏈終止法
相關詞條
- 雙脫氧鏈終止法
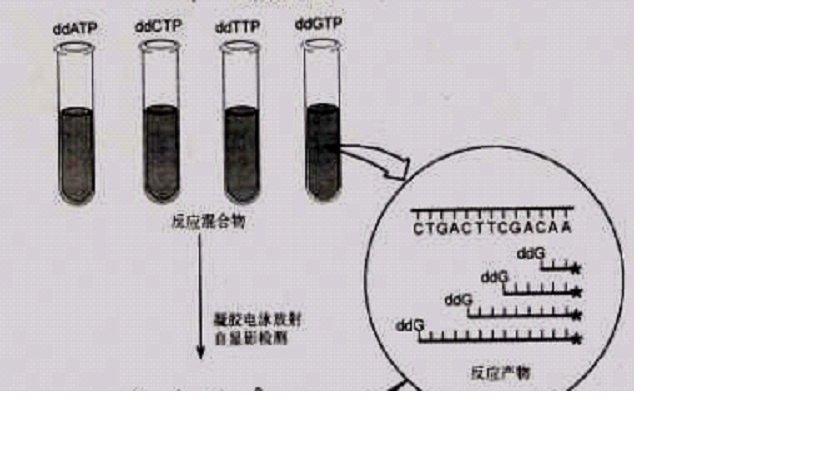
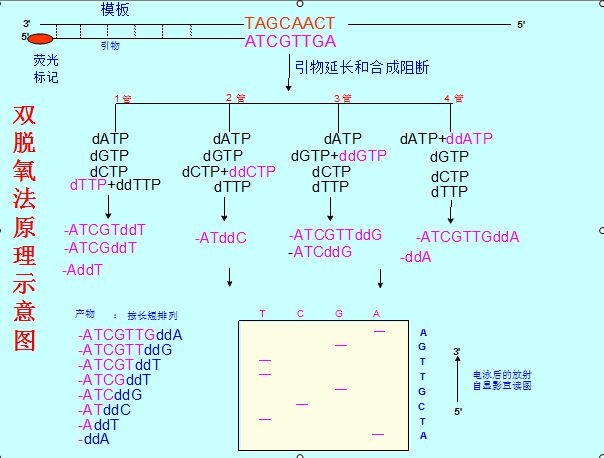
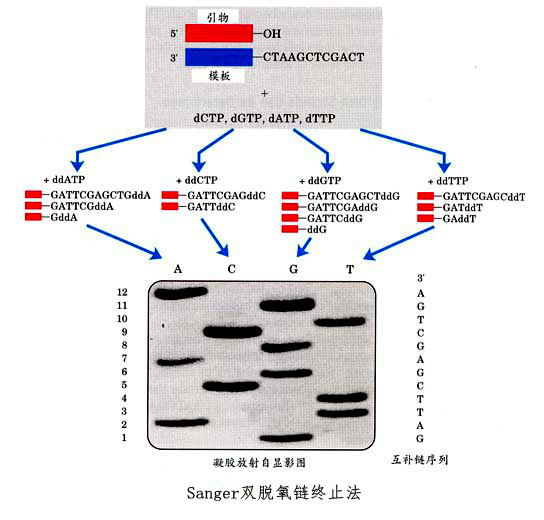
雙脫氧鏈終止法主要用於DNA基因分析,是現在套用最多的核酸測序技術(也即第一代DNA測序技術),由Sanger等1977年發明提出。...
- 末端終止法
末端終止法是用來測DNA序列即SANGER雙脫氧鏈終止法。...... 末端終止法是用來測DNA序列即SANGER雙脫氧鏈終止法。中文名 末端終止法 別稱 SANGER雙脫氧鏈終止法 ...
- 鏈終止DNA測序法
鏈終止DNA測序法基本原理是,聚丙烯醯胺凝膠能把長度只差一個核苷酸的單鏈DNA分子區分開,這意味著在長10-1500個核苷酸的範圍內,所有分子經電泳後可成為一系列可分辨...
- 雙脫氧測序法
雙脫氧測序法又名Sanger雙脫氧鏈終止法,是用以確定核酸中核苷酸序列的一個方法。Sanger法是根據核苷酸在某一固定的點開始,隨機在某一個特定的鹼基處終止,並且在...
- 核苷酸序列分析法
有化學序列分析法、酶法以及雙脫氧鏈終止法MB序列分析技術等方法。其中雙脫氧鏈終止法MB序列分析技術因具有快速、準確、簡便,比化學序列法省力等優點,越來越受到研究...
- 分子生物學實驗技術
(三)雙功能抗體277(四)抗體融合蛋白278第十章測序及人工合成技術279第一節DNA序列測定279一、Sanger雙脫氧鏈終止法279(一)Sanger雙脫氧鏈終止法的原理279...
- 基因診斷技術
Sanger法就是使用DNA聚合酶和雙脫氧鏈終止物測定DNA核苷酸序列的方法。它要求使用一種單鏈的DNA模板或經變性的雙鏈DNA模板和一種恰當的DNA合成引物。其基本原理是...
- ddATP
ddATP的作用是套用於雙脫氧鏈末端終止法。...... ddATP的作用是套用於雙脫氧鏈末端終止法。ddATP (三磷酸腺嘌呤雙脫氧核苷酸)組成:一分子核糖,其中2號3號C上羥基...
- DNA測序儀
DNA序列測定分手工測序和自動測序,手工測序包括sanger雙脫氧鏈終止法和maxam-gilbert化學降解法。自動化測序實際上已成為當今 dna序列分析的主流。美國pe abi公司已...
- 動物基因工程
一、sanger雙脫氧鏈終止法二、Maxam-GilbenDNA化學降解法第五節 PCR擴增技術一、基本原理二、PCR的設計和參數***CR技術的套用第六...
- 基因測序儀
目前DNA測序儀的工作原理主要基於Sanger發明的雙脫氧鏈末端終止法或Maxam-Gilbert發明的化學降解法。這兩種方法在原理上雖然不同,但都是根據在某一固定的位點開始...
- Sanger法測序
Sanger法測序 方法 Sanger雙脫氧鏈終止法 作用 DNA測序的技術 對象 核苷酸 原理利用一種DNA聚合酶來延伸結合在待定序列模板上的引物。直到摻入一種鏈終止核苷酸...
- 基因工程(2017年高等教育出版社出版圖書)
一、 雙脫氧鏈終止法 二、 Maxam-Gilbert 化學降解法 三、 DNA 雜交測序 四、 DNA 自動化測序 五、 第二代測序技術 六、 第三代測序技術 第六節 DNA 與蛋...
- DNA序列分析
目前用於測序分析的方法有Sanger(1977)的雙脫氧鏈末端終止法和Maxam與Gilbert(1977)的化學降解法兩種。[1] 雙脫氧鏈末端終止法的巧妙之處在於引入了雙脫氧核苷三...
- DNA的結構與功能
1.Sanger雙脫氧鏈終止法 DNA的合成總是從5′端向3′端進行的。DNA的合成需要模板以及相應的引導核酸鏈。DNA的合成過程中,在合成的DNA鏈的3′末端,依據鹼基配對...
- DNA測序技術
DNA測序技術,即測定DNA序列的技術。在分子生物學研究中,DNA的序列分析是進一步研究和改造目的基因的基礎。目前用於測序的技術主要有Sanger等(1977)發明的雙脫氧鏈末端...
- 實用分子生物學技術
二、Sangcr雙脫氧鏈終止法三、MaXam—Gilben化學測序法四、焦磷酸測序技術五、DNA序列測定技術的發展參考文獻第七章 重組產物的表達、分析和純化...
- 分子生物學技術在中醫藥研究中的套用
實驗5 dna雙脫氧鏈終止法測序第三章 中醫藥對單基因轉錄作用的研究實驗6 組織總rna提取實驗7 mrna的分離實驗8 northern blot實驗9 rt-pcr...
- 醫學生物化學與分子生物學實驗技術(第2版)
三、酶學法與化學法的比較.141第3節DNA測序自動化143第4節實驗練習...144雙脫氧鏈終止法測定DNA序列...144轉基因技術...147第1節轉基因技術概述...
- 分子生物學實驗指導(高等教育出版社2007年版圖書)
實驗十三 PCR法差異顯示mRNA 實驗十四 利用聚合酶鏈反應(PCR)定點突變 實驗十五 寡核苷酸介導的定點突變 實驗十六 Southern雜交 實驗十七 雙脫氧鏈終止法測定DNA序列...
- 基因工程概論
一、Sanger酶法( 雙脫氧鏈終止法) /270二、Maxam-Gilbert DNA 化學降解法/273三、定向測序法/276四、鳥槍法測序/278五、人工轉座子法/282六、雜交測序技術/...