基本介紹 鈦粉、
氫化鈦 粉: 純度:95-99.4%等各種規格 性 狀:鈦粉:產品呈
銀灰色 不規則狀粉末,有大的吸氣能力,高溫或電火花條件下易燃。 氫化鈦粉:產品呈黑灰色不規則狀粉末。 用途鈦粉及氫化鈦粉是一種用途非常廣泛的金屬粉末。是
粉末冶金 、合金材料添加劑。 同時也是
金屬陶瓷 ,表面
塗復 劑,鋁合金添加劑,電真空
吸氣劑 ,噴、鍍等重要原材料。 粒度-40目到-300目.
松裝密度 :1.2-1.6(g/cm3) 包裝:20公斤紙箱包裝,每箱4袋,經雙方協商可提供真空小包裝。
鈦粉化學元素含量 Ti Fe Si O C N Cl H Al V Ti-1 99.4 0.08 0.02 0.35 0.02 0.04 0.06 0.02 Ti-2 99.2 0.10 0.03 0.50 0.03 0.05 0.08 0.02 Ti-3 99.0 0.15 0.05 0.60 0.06 0.08 0.10 0.04 Ti-4 98.0 0.35 0.17 0.80 0.08 0.10 0.17 0.15 Ti-5 95.0 0.45 0.17 0.90 0.09 0.080 0.17 0.20 1.60 1.88
氫化鈦粉化學元素含量 Ti Fe Si O C N Cl Al V TiH2-1 99.4 0.08 0.02 0.40 0.02 0.03 0.06 TiH2-2 98.0 0.35 0.15 0.80 0.10 0.10 0.17 TiH2-3 95.0 0.45 0.17 0.90 0.09 0.08 0.17 1.60 1.88
物理性質 在
金屬 元素 中,鈦的
比強度 很高。它是一種高強度但低質量的金屬,而且具有相當好的
延展性 (尤其是在無
氧 的環境下)。鈦的表面呈銀白色金屬光澤。它的熔點相當地高(超過1,649
攝氏度 ),所以是良好的耐火金屬材料。它具有
順磁性 ,其
電導率 及
熱導率 皆甚低。
商業等級的鈦(純度為99.2%)具有約為434
兆 帕斯卡 的極限
抗拉強度 ,與低等級的鋼合金相若,但比鋼合金要輕45%。鈦的
密度 比鋁高60%,但強度是常見的6061-T6鋁合金的兩倍。鈦可被用於各種用途。某些鈦合金(例如βC)的抗拉強度達1,400兆帕斯卡。然而,當鈦被加熱至430攝氏度以上時,強度會減弱。
儘管比不上高等級的熱處理鋼,鈦仍具有相當的硬度。鈦不具磁性,同時是不良的導熱及導電體。用機械處理時需要注意,因為如不採用鋒利的器具及適當的冷卻手法,鈦會軟化,並留有壓痕。像鋼結構體一樣,鈦結構體也有
疲勞極限 ,因此在某些套用上可保證持久耐用。鈦合金的比勁度一般不如鋁合金及
碳纖維 等其他物料,所以較少套用於需要高剛度的結構上。
鈦具有兩種
同素異形體 ,在882攝氏度時,就會從六方最密堆積的α型轉變成體心立方的β型。在到達臨界溫度前,α型的
比熱 會隨著升溫而暴增,但到達後會下降,然後在β型下不論溫度地保持基本恆定。跟
鋯 和
鉿 類似,鈦還存在一種ω態,在高壓時熱力學穩定,但也可能在常壓下以介穩態存在。此態一般是六邊形(理想)或三角形(扭曲),在軟性縱波聲頻
光子 導致β型(111)原子平面倒塌時能被觀測到。
化學性質 鈦的特性中,最為人稱道的就是它優良的抗腐蝕能力——它的抗蝕性幾乎跟
鉑 一樣好,鈦不受稀
硫酸 、稀
鹽酸 、氯氣、氯溶液及大部分有機酸的腐蝕,但仍可被濃酸溶解。雖然以下的
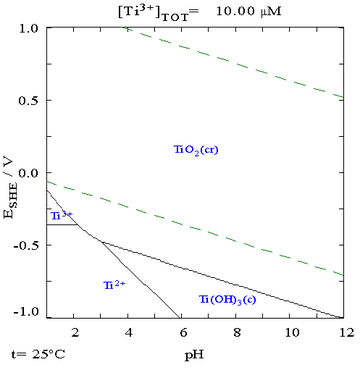
電位-pH圖 指出鈦在熱力學上是一種活性很高的金屬,但是它與水及空氣的反應是非常緩慢的。
鈦在曝露在高溫空氣中時,會生成一層
鈍 氧化物保護膜,阻止氧化持續。在最初形成時,保護層只有一至二納米厚,但會緩慢地持續增厚;四年間可達25納米厚。但當鈦被置於高溫空氣中時,便很容易與氧產生反應。
這個反應在空氣溫度達1200攝氏度時便會發生,而在純氧中最低只需610攝氏度,生成二氧化鈦。因此不能在空氣中熔掉鈦,因為在到達熔點前鈦會先燃燒起來,所以只能在惰性氣體或真空中熔化鈦。在550攝氏度時,鈦會與氯氣結合。鈦亦會與其他鹵素結合,並吸收氫氣。
鈦也是少數會在純氮氣中燃燒的元素,達800攝氏度就會燃燒起來,生成一氮化鈦,導致脆化。
實驗指出,天然鈦在受到氘核轟擊後會具有放射性,主要釋放出
正電子 及硬性
γ射線 。 【在純水、高氯酸或氫氧化鈉中的鈦電位-pH圖見右圖】
化合物 氧化態 +4在鈦化學中占首要地位,但
氧化態 為+3的化合物亦屬常見。正因為這樣的高氧化態,許多鈦化合物中的
共價鍵 高度密集。
氮化鈦 (TiN)具有與
藍寶石 及
金剛砂 相當的硬度(
摩氏硬度 9.0),因此可作為各種切割工具的塗層,例如鑽頭。它的其他套用還包括裝飾用金色塗料及半導體器件製造中銅導線界面的擴散阻障層。
帶氮化鈦鍍膜的鑽頭
天然含量 2003年二氧化鈦的產量 出產地 產量(千噸) 占總產量% 1291.0
30.6
850.0
20.1
767.0
18.2
382.9
9.1
357.0
8.5
其他國家
573.1
13.6
全世界
4221.0
100.0
由於四捨五入的關係,數值總和並不等於100%。
自然中的鈦總是與其他元素結合成化合物。它是
地殼 中含量第九高的元素(
質量 占地殼0.63%),同時也是第七高的金屬。大部分的
火成岩 及由其演變成的
沉積岩 都含有鈦(生物及天然水體也含有鈦)。實際上,在
美國地質調查局 分析過的801種火成岩中,784種含有鈦鈦大約占土壤的0.5至1.5%。。
鈦可以在
隕石 中找到,並且已在
太陽 及M型
恆星 處偵測到鈦;M型恆星是溫度最冷的恆星,表面溫度為3,200攝氏度。在
阿波羅17號 任務從
月球 帶回的
岩石 中,二氧化鈦含量達12.1%。鈦還可以在
煤 灰、植物,甚至
人體 中找到。
同位素 主條目:鈦的同位素
天然生的鈦有五種穩定的
同位素 :Ti、Ti、Ti、Ti及Ti,其中最常見的是Ti(
天然豐度 為73.8%)。現時已知鈦共有十一種
放射性同位素 ,其中比較穩定的有Ti(
半衰期 63年)、Ti(半衰期184.8分鐘)、Ti(半衰期5.76分鐘)及Ti(半衰期1.7分鐘)。而剩下的其他
放射性 同位素,半衰期最長只有33秒,而大部分的半衰期更在半秒以下。
鈦各同位素的原子重量,最輕有39.99
u (Ti),最重有57.966u(Ti)。最常見的穩定同位素,Ti,其主要
衰變模式 為
電子捕獲 ,衰變產物為元素21(
鈧 )的同位素;而其次的衰變模式為
β衰變 ,產物為元素23(
釩 )的同位素。
歷史 1791年,鈦以含鈦
礦物 的形式在
英格蘭 的
康沃爾郡 被發現,發現者是英格蘭業餘礦物學家
格雷戈爾 (Reverend William Gregor),當時正業為負責
康沃爾郡 的
克里特 (Creed)教區的牧師。他在鄰近的馬納坎
教區 中小溪旁找到了一些黑沙,後來他發現了那些沙會被
磁鐵 吸引,他意識到這種礦物(鈦鐵礦)包含著一種新的元素。經過分析,發現沙裡面有兩種金屬氧化物;
氧化鐵 (沙受磁鐵吸引的原因)及一種他無法辨識的白色金屬氧化物(45.25%)。意識到這種未被辨識的氧化物含有一種未被發現的金屬,格雷戈爾對康沃爾郡皇家地質學會及德國的《化學年刊》發表了這次的發現。
大約就在同時,米勒·馮·賴興斯泰因(Franz-Joseph Müller von Reichenstein)也製造出類似的物質,但卻無法辨識它。直到1795年,普魯士化學家
克拉普羅特 (Martin Heinrich Klaproth)獨立地從
匈牙利 的金紅石中再度發現到這種氧化物。克拉普羅特發現到它含有一種新的物質,並以
希臘神話 中的
泰坦 (Titans)為其命名。當他聽聞到格雷戈爾較早前的發現之後,克拉普羅特取得了一些馬納坎礦物的樣本,並證實它含鈦。
從各種含鈦礦物中提煉鈦的過程既費工又昂貴;不能像對其他金屬地用碳去還原鈦,因為鈦與碳加熱時會生成
碳化鈦 。歷史上最早製備出純鈦(99.9%),一直要到1910年,
美國 倫斯勒理工學院 的
亨特 (Matthew A. Hunter)將
四氯化鈦 和
鈉 一起加熱至700-800攝氏度,提煉出高純度的鈦,這種方法被稱為亨特法。但是這時鈦的套用仍只限於實驗室,直到1932年
克羅爾 (William Justin Kroll)證明出可以利用
鎂 將四氯化鈦還原以提煉出鈦。八年後他改良了這個過程,當中使用鎂甚至是鈉來還原鈦,後來被稱為克羅爾法。儘管研究如何能更有效及便宜地提煉鈦的工作仍然持續(例如
FFC劍橋法 ),但是鈦金屬的商業提煉還在使用克羅爾法。
以克羅爾法製造出來的海錦鈦
1925年,范·亞克(Anton Eduard van Arkel)及德·波耳(Jan Hendrik de Boer)發現了
晶棒法 (又稱碘化物精煉法),即與碘反應後再用熱燈絲從蒸氣中分離出純金屬,利用這個方法可生產出少量的超純鈦。
在1950年代至60年代年間,
蘇聯 率先將鈦用於軍事及潛艇用途(661型潛艇、705型核潛艇、
M級核潛艇 ),作為對
冷戰 的部分規劃。自1950年代初起,鈦開始被用於各種軍事航空用途,尤其是製造高性能噴射機,最初的機體包括F-100超級軍刀及
洛克希德A-12 。
在美國,
國防部 意識到鈦這種金屬的戰略重要性,並支持了鈦早期的商業化行動。在整個冷戰時期期間,鈦一直被美國政府視為戰略材料,國家防禦儲備中心內有大量海錦鈦庫存,直至2005年用盡為止。現時世界最大的鈦生產商,是俄羅斯的VSMPO-Avisma,據估計這家公司的全球市場占有率達29%。
2006年美國國防部國防高等研究計畫署向兩家公司聯合撥款五百七十萬美元,研發製造鈦金屬
粉末 的新方法。在熱力與壓力下,這種粉末可用於製作各種強度高且重量輕的物件,從裝甲敷板到宇宙航行、運輸、化工用元件。
製備 鈦(精礦)
處理鈦金屬主要分四個步驟:一、把鈦礦石還原成“海綿體”(一種透氣的形態);二、製造鑄錠,熔化海綿體(或用海綿體加一種母合金)來形成鑄錠;三、初步製造,把鑄錠製成一般機械製品,如坯、棒、板、片、條及管;四、加工製造,把機械製品進一步加工成型。
由於鈦在高溫時會與氧氣反應的關係,所以不能用
還原反應 來從氧化物中提煉鈦。因此商業上提煉鈦金屬要用到克羅爾法,一種既繁複又昂貴的分批處理法。(鈦的市價相對地高,是因為在提煉的過程中,需要氧化另一種昂貴的金屬——鎂。)在克羅爾法中,氧化物首先經過碳氯化,轉化成氯化物,過程中
氯氣 會在有碳的情況下,通過紅熱的
金紅石 或
鈦鐵礦 ,生成
四氯化鈦 (TiCl
4 )。氯化物經
分餾法 濃縮及提純後,在800攝氏度的
氬氣 中被熔
鎂 還原 成鈦。
一種最近開發的提煉法,
FFC劍橋法 ,日後有可能完全取代克羅爾法。此法的原料是粉末狀的
二氧化鈦 (一種精煉過的
金紅石 ),而最後成品則會是鈦粉末或海綿體。假如在原料的粉末中混入粉末狀的氧化物,那么成品就會是廉價鈦合金,這樣做比使用一般的多步熔化法要便宜得多。FFC劍橋法使鈦不像從前那樣的如此稀少和昂貴,可為
航天 工業及奢侈品市場提供更多的選擇,同時可取代一些製品中的
鋁 或特殊等級的
鋼 。
一般鈦
合金 是由還原反應所造出來的。例如,銅鈦合金(把加了銅的金紅石還原而成)、碳鈦鐵合金(把鈦鐵礦和焦炭用電爐還原而成)和錳鈦合金(
金紅石 加錳或氧化錳)都是經還原而成的。
現時鈦與鈦合金共有大約50種指定
品位 ,儘管市面上能容易買到的就只有六種。
美國材料試驗協會 (ASTM)承認31種鈦金屬及合金品位,其中1至4號品位在商業上屬純鈦(非合金)。這四種品位以它們不同的抗拉強度區分,也就是含氧百分比,其中1號品位韌性最佳(抗拉強度低,含氧量0.18%),4號最差(抗拉強度高,含氧量0.40%)。其餘品位皆為合金,每一種配方都有其特定的用途,例如韌性、強度、硬度、電阻、抗
蠕變 及抗
腐蝕 (特定某種介質或同時多種)。
美國材料試驗協會所指定的品位及其他合金,亦會按照各種規格生產,例如宇宙航行及軍事規格(SAE-AMS, MIL-T)、ISO標準、各國的特定標準以及用家所需的規格(宇宙航行、軍事、醫學及工業用)。
至於加工方面,鈦的所有
焊接 必需在
氬 或
氦 其中一種惰性氣體中進行,否則鈦會被空氣中的氧、
氮 或
氫 等氣體污染。污染會引起各種情況,包括脆化,而脆化會減低焊接後的整體性,並導致連線失敗。商業純鈦的扁平產品(片、板)製造起來很容易,但處理時必須注意鈦金屬有“記憶”特性,有彈回原形的傾向。有幾種高強度合金更尤其如此。鈦金屬一般可以用跟
不鏽鋼 一樣的機器及方法處理。
用途 鈦制圓柱體,品質為“2號品位”
鈦是
鋼 的一種合金用元素(
鈦鐵 ),鈦會縮小鋼的晶粒尺寸,同時作為
脫氧劑 的鈦會減低鋼的含氧量;在
不鏽鋼 中加鈦會減低含碳量。鈦常與其他金屬製成合金,這些金屬有鋁(改良晶粒大小)、
釩 、
銅 (硬化)、
鎂 及
鉬 等。鈦的機械製品(片、板、管、線、鍛件、鑄件)在工業、宇宙航行、休閒及
新興市場 上都有套用。鈦粉在煙火製造上用於提供明亮的燃燒顆粒。
顏料、添加劑及塗料 二氧化鈦是最常用的鈦化合物
粉末狀的Ti
O 2 化學上具惰性,陽光下不褪色,而且很不透光:就是這些性質,使得它能夠為製造家用塑膠的灰色或棕色化學品帶來艷麗的純白色。在自然中,二氧化鈦這種化合物可在
銳鈦礦 、
板鈦礦 及金紅石這幾種
礦物 中找到。用二氧化鈦製成的塗料能夠耐高溫,輕度阻止塵污積聚,及抵受海洋環境帶來的影響。純二氧化鈦的
折射率 非常高,而且對光學色散能力比
鑽石 還高。除了作為一種很重要的顏料之外,
防曬油 也要用到二氧化鈦,因為它本身就能保護皮膚。
最近,它還被用在
空氣淨化器 (過濾器塗層),及貼在建築物窗上的薄膜,這種薄膜在接觸到
紫外線 (太陽或人工)或空氣中的水分時,會產生帶高度活性的氧化還原物種,如羥基,能淨化空氣或保持窗面清潔。
宇宙航行及航海 由於它的高
抗拉強度 -密度比、優良的抗腐蝕性、抗疲乏性、抗裂痕性及能夠在沒有
蠕變 的情況下抵受適度高溫,鈦合金被用於
航空器 、裝甲敷板、
海軍 艦隻、
太空飛行器 與
飛彈 。在這些套用中,鈦與鋁、釩及其他元素所製成的合金,用於製造各種元件,包括關鍵的架構部件、防火牆、
起落架 、排氣管(直升機)及液壓系統。事實上,約三分二的鈦金屬生產量被用於製造太空船引擎及構架。SR-71“黑鳥”是最早在架構上廣泛使用鈦的機體,為現代軍用及商用機體的鈦套用鋪好了路。據估計,生產
波音777 要用59噸鈦,
波音747 要44噸,
波音737 要18噸,
空中客車A340 要32噸,
空中客車A330 要18噸,
空中客車A320 要12噸。
空中客車A380 可能要用146噸,其中引擎要26噸。在引擎套用上,鈦被用於
轉子 、壓縮機葉片、液壓系統元件及短艙。在航空套用的鈦合金中,鈦-6鋁-4釩占幾乎50%。
由於不易被
海水 腐蝕,鈦被用於製造螺槳軸、索具及用於
海水淡化廠 的
換熱器 ;還被用於鹹水
水族館 的冷熱水器、釣魚線及潛水用刀。鈦被用於製造海洋監視部署的住房及其他元件,及用於以及科學用或軍用的監察儀。前
蘇聯 研發出主要用鈦製造
潛艇 的技術。
工業 化工及石油化工領域需要用到焊鈦制的管道及加工設備(換熱器、槽、加工用容器、閥),主要原因是鈦的抗腐蝕性。井內與
鎳 濕法冶金 套用要用到特定的幾種合金,如鈦βC,因為需要高強度、高抗腐蝕性或兩者同時。製紙業某些會面對腐蝕性介質的生產設備會用到鈦,這些腐蝕性介質包括次氯酸鈉或濕氯氣(用於漂白)。其他套用包括:
超音波焊接 、熔錫波焊及
濺鍍 靶材。
四氯化鈦 (TiCl
4 )是一種無色液體,在生產二氧化鈦的過程中的是一種重要的中間物,可用於生產
齊格勒-納塔催化劑 及製造鍍銥
玻璃 ,還由於它在濕氣中會產生濃煙,所以可以用四氯化鈦來製造煙幕。
消費品及建材 鈦金屬被用於汽車,尤其是賽車(汽車或摩托),在這領域減低重量,但同時不失強度及剛度是極其重要的。一般來說,鈦金屬對普羅大眾的消費市場來說太昂貴了,很難會有銷路,所以它的主要市場是高檔產品,尤其是競賽用/高性能市場。最新款的
Corvette 跑車可選配鈦制排氣系統。
西班牙畢爾包古根漢美術館的外牆鈦壁板
鈦被用於各種體育用品:
網球拍 、
高爾夫球桿 、
袋棍球 棒手柄;
板球 、
曲棍球 、袋棍球及
美式足球 的頭盔上的護架;以及
腳踏車 的骨架及元件。儘管鈦並不是腳踏車生產的主流材料,但仍有運動選手及腳踏車冒險愛好者使用鈦制的腳踏車。鈦合金亦被用於製造
眼鏡 框架,雖然這種鏡框會有點昂貴,但是它重量輕又很經久耐用,而且不會造成皮膚敏感。許多野外
背包客 都有鈦制的裝備,包括煮食用具、餐具、提燈及帳蓬的標樁。雖然比傳統的鋼或鋁製的同類稍貴,這些鈦製品要輕得多但強度不減。蹄鐵匠也偏好使用鈦,因為鈦制的
馬蹄鐵 比鋼製的更輕且更耐用。
適用於野外背包客的鈦
叉勺 約重16克,比鋼製餐具更輕,但比膠制的更堅固。
由於它的耐久性,鈦制的名牌
珠寶 (尤其是
鈦戒指 )開始普遍起來。鈦的惰性成了要選擇它的原因,特別是對有皮膚敏感或會在特定環境中(如游泳池)佩戴首飾的人。鈦的耐久性、輕重量、防凹性及耐腐蝕性,使它成為生產
手錶 外殼用的理想材料。有些藝術家用鈦來製作藝術品,例如雕塑、裝飾品及家具。
鈦偶爾會被用在有關建築的套用上:位於
莫斯科 高40米的加加林紀念柱,為紀念第一名太空人
尤里·加加林 而建造,就是以鈦建成的,選用鈦的原因是因為它吸引的顏色以及跟火箭技術的關連。西班牙的畢爾包古根漢美術館及美國
喜瑞都 的千禧圖書館分別是歐洲和北美最早使用鈦壁板護層的建築。其他使用鈦壁板護層的建築還有位於美國
科羅拉多州 丹佛 藝術博物館的漢密頓樓,及位於
莫斯科 高107米的征服太空紀念碑。
比起槍枝傳統上用的金屬(鋼、
不鏽鋼 及鋁),鈦的強度低質量較為優勝,加上在金屬製造上的發展,用鈦來製造槍枝開始變得普遍。主要用途包括
手槍 支架及
左輪手槍 的轉輪。基於同樣的理由,筆記本電腦的主體也會用到鈦(例如
蘋果 的
PowerBook 系列)。
有些高價位市場賣的工具,既輕量又耐腐蝕,例如鏟子及手電筒,也會用鈦合金製造。
醫學 由於它的生物相容性(無毒及不被人體排斥),鈦在醫學上有廣泛套用,當中包括外科用具及植入物,例如替換髖骨框及球關節,最長可用20年。這種用途的鈦一般與4%鋁或6%鋁加4%釩製成合金。
鈦有一種固有的骨融合特性,使得鈦制的牙科植入物能在原位上逗留30年。這種特性對整形植入物而言亦相當有用。使用鈦的好處還有鈦較低的彈性模量(
楊氏模量 ),與骨較為接近,植入物是以修補骨骼為目的而造。因此骨骼負重會更平均地分布於骨及植入物之間,這樣會減低骨質流失的機會,因為如果負重不均就會有應力遮閉(骨骼應力因植入物而減低所導致的骨質流失),以及外科植入物與骨之間的義肢周骨折。然而,鈦合金的剛性仍是骨的兩倍,所以植入物周邊骨的受力仍是會大幅減少,並可能因此退化。
由於鈦不具
鐵磁性 ,有鈦植入物的病人能安全地接受
核磁共振成像 的檢查(這對有長期植入物的人士來說是很方便的)。準備植入人體的鈦要經過
等離子 弧的高溫加熱,移除表面原子,新露出的表面隨即被氧化。
鈦被製成圖像導引手術用的外科器具,還有輪椅、丁形拐杖及其他需要高強度低重量的產品。
危害 鈦沒有毒性,即使大劑量時也是如此,鈦在人體中不會發生任何自然作用。據估計,人每天會攝取約0.8毫克鈦,但大部分都在沒有被吸收的情況下通過。然而,含有
矽土 的組織會出現
生物累積 鈦的傾向。在
植物 中,一種未知的機制可能會用鈦來刺激
碳水化合物 的生產並促進生長。這可能解釋到為何大部分植物的含鈦量約為百萬分之1(ppm),而食用植物的含鈦量則約為2ppm,
木賊 及
蕁麻 更最高可達80ppm。
粉末狀的鈦及刨削下來的鈦薄片很容易引起火災,而且在
空氣 中會因加熱而發生爆炸。水及
二氧化碳 類的滅火法對燃燒中的鈦無效;必須改為使用D類乾粉滅火劑。
當生產或處理
氯氣 時,必須小心注意鈦只能用在周圍沒有乾氯氣的地方,否則會引起鈦/氯火災。即使是濕氯氣也是火災隱患,因為在異常的天氣狀況下濕氯氣可能會意外地變乾。
鈦未經氧化的新表面與
液態氧 接觸後可能會起火。這種表面可以由經氧化的鈦表面跟硬物碰撞後所形成,或在力學
應變 導致的裂痕內形成。因此在液態氧的系統內使用鈦很可能有限制,例如宇宙航行工業就會有這種系統。
鈦粉用途 套用於航天,噴塗,冶金,煙花等行業