基本介紹
- 中文名:電位-pH圖
- 外文名:Pourbaix diagram
簡介
電位-pH圖的構建
- 列出有關物質的各種存在狀態及其化學勢值;
- 寫出相關物質之間反應的平衡關係式;
- 畫出各類反應的電位-pH圖,最後匯總。
標準電極電勢

參看
- 自由能-氧化數圖
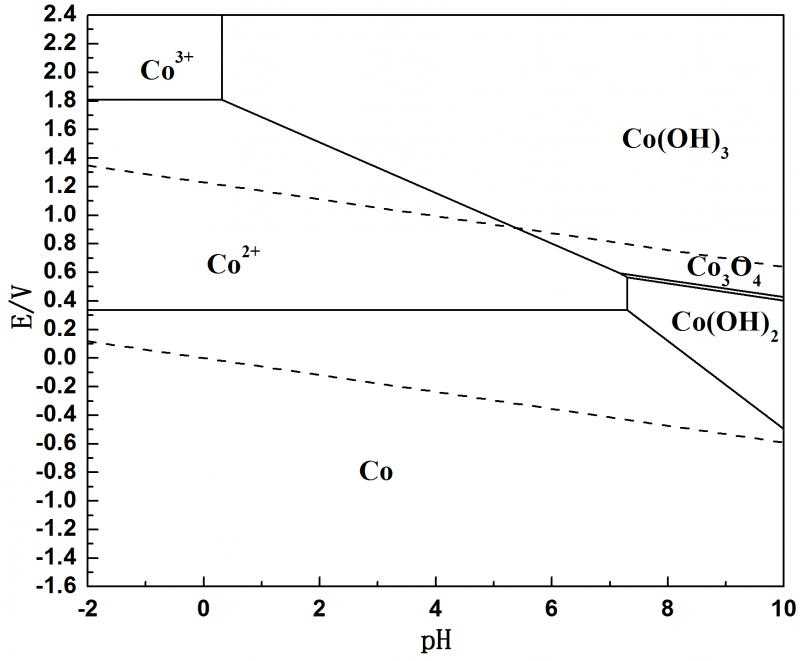

電位-pH圖,也稱電勢-pH圖、穩定區圖、普爾貝圖,是表示系統的電極電勢與pH關係的圖,它在電化學中有很重要的意義。最早由比利時學者馬塞爾·普爾貝(Marcel Pourbaix...
電位-pH圖,也稱電勢pH圖、優勢區圖、穩定區圖、普爾貝圖,是表示體系的電極電勢與pH關係的圖,它在電化學中有很重要的意義。它相當於相平衡時的相圖,是一種電...
電位對電極反應平衡狀態會產生影響,將體系分成單相(溶液)和多相(固體—溶液與氣體—溶液)進行分析,可導出其對應的關係方程式。這些方程式代表了電位和pH對電極反應...
定義介紹 電位-PF圖pntcntial-}H diagram從J幾化學熱力學原理 建立起來的一種電化學平衡圖。最簡單的圖僅涉及某一元素 與水構成的體系‘圖‘}‘明確示呂在呆...
《銅-氨水、銅-氯水及砷酸鐵-水系綜合平衡電位-PH系列圖研究》是一部出版的論文,作者是駱如鐵。...
溶液pH的電位測定法是指當一個 pH指示電極(如玻璃電極)和一個參比電極插入被測溶液時,參比電極與指示電極間的電位差決定於溶液的pH。...
PH測量中使用的電極又稱為原電池。把pH玻璃電極和參比電極組合在一起的電極就...其中一個半電池稱作測量電池,它的電位與特定的離子活度有關;另一個半電池為參...
pH電極又稱pH探頭、pH感測器,英文名稱pH electrode或pH sensor,是PH計上與被測物質接觸的部分,用來測電極電位的裝置。...
用筆型PH計|酸度計進行電位測量是測量pH最精密的方法。筆型PH計|酸度計由三個部件構成:...
PHS-3CPH計,適用於大專院校、研究院所、工礦企業、食品企業的化驗室取樣測定水溶液的pH值和電位(mV)值、此外,還可配上離子選擇性電極,測出該電極的電極電位。...
