基本介紹
- 中文名:共軛酸
- 英文名:Conjugate acid
- 套用:共軛酸鹼對
- 特點:共軛結構
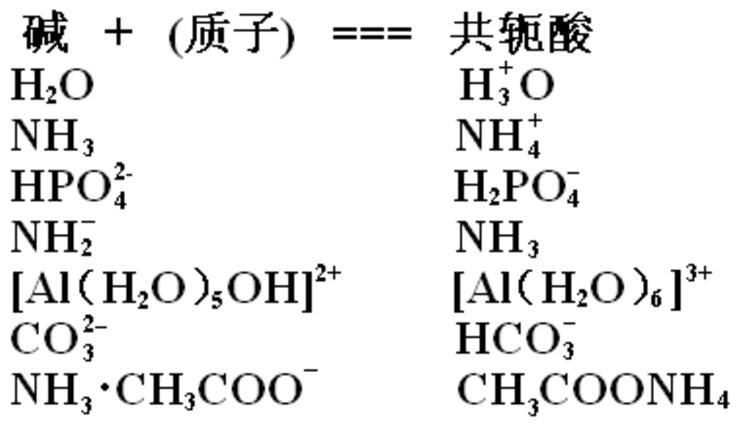
共軛酸酸鹼質子理論 編輯 根據布朗斯特德和勞萊的酸鹼質子理論,認為酸是能給出質子的物質,鹼是能接受質子的物質。酸失去質子,變成該酸的共扼鹼鹼得到質子後變成該...
根據現代無機化學的定義:凡是能給出質子的物質都是酸,凡是能與質子結合的物質都是鹼,酸與鹼之間的這種關係稱為酸鹼共軛關係,相對應的酸鹼稱為共軛酸鹼。...
質子理論闡述,能給出質子的分子或離子是酸,能接受質子的分子或離子是鹼,酸給出質子轉變為相應的鹼,鹼接受質子轉變為相應的酸,這種因質子得失而相互轉變的一對...
雙分子共軛鹼消除:即E2反應,反應體系中若有鹼存在,則隨著鹼濃度的提高,消除產物增多。這說明反應速度不僅與鹵代烷的濃度有關,而且還與鹼的濃度有關,在動力學上...
酸度係數,又名酸離解常數,代號Ka值,在化學及生物化學中,是指一個特定的平衡...*:表示數值是用其共軛酸所測得。附註:pK是解離常數水溶液中具有一定離解度的...
同時,易證得:在水溶液中, ,因此,共軛酸的酸性越強,共軛鹼的鹼性越弱,反之,共軛酸的酸性越弱,共軛鹼的鹼性越強。酸鹼理論酸鹼反應 在以下反應中:...
酸放出質子後形成的鹼,叫做該酸的共軛鹼;鹼接受質子後形成的酸,叫做該鹼的共軛酸。我們把相差一個質子的對應酸鹼,叫做共軛酸鹼對。...
超強酸是一類酸性比濃硫酸還強的酸。世界上已開發和研製了比硫酸、鹽酸、硝酸酸性強幾百萬倍,甚至幾十億倍的超強酸。以HSO3F-SbF5為例,超酸比100%硫酸強1019...
酸鹼質子理論認為,在化學反應過程中,凡是能給出質子(H+)的物質都是酸,凡是能接受質子的物質都是鹼。酸鹼反應實際上是酸、鹼之間的質子傳遞反應,其反應方向總是...
Brönsted酸鹼理論認為,能放出質子的物質為酸,放出質子後的物質為該酸的共軛鹼;能接受質子的物質為鹼,接受質子後的物質為該鹼的共軛酸。Brönsted酸性強度實際...
Bronsted J N和Lowry T M提出,凡是能放出質子的物質為酸,也就是B酸,能與質子結合的物質為鹼,酸放出質子後即形成該酸的共軛鹼,同樣,所有的鹼也有著共軛酸。...
酸度係數(pKa),又名酸離解常數,是酸解離平衡常數的常用對數的相反數,其定義式為pKa=-lg(Ka)。酸度係數是隸屬於酸鹼質子理論的概念,它反映了一種酸將質子傳遞...
碳酸氫根(HCO3-)的原子排布為平面結構,碳位於中心,與三個氧原子鍵連(一個C=O,一個C-OH,一個C-O-)。它是碳酸的共軛鹼,也是碳酸根離子的共軛酸。水溶液中...
常用作緩衝溶液的酸類由弱酸及其共軛酸鹽組合成的溶液具有緩衝作用。常見的緩衝體系有: 1、弱酸和它的鹽(如HAc---NaAc) 2、弱鹼和它的鹽(NH3·H2O---NH4Cl...
超酸溶劑體系是指在水溶液中所有的強酸(如HNO3 ,H2SO4 ,HSO3F,HCIO4)與水完全反應生成H3O+,酸強度被拉平。然而,在一些酸性非水溶劑中拉平作用不會發生,酸強度...
KBH+是指示劑的共軛酸的電離常數,可用一般的測定平衡常數的方法測得,而[BH+]/[B]是指示劑的電離比率,可通過紫外-可見光光度法測定。H0標度可以看作是對pH標...
鹼強度超過強鹼(即共軛酸的pKa>26)的鹼為超強鹼。有布侖斯惕超強鹼,路易斯超強鹼。有固體、液體兩類超強鹼。用於催化某些化學反應的超強鹼為超強鹼催化劑。...
