質子理論闡述,能給出質子的分子或離子是酸,能接受質子的分子或離子是鹼,酸給出質子轉變為相應的鹼,鹼接受質子轉變為相應的酸,這種因質子得失而相互轉變的一對酸鹼稱為共軛酸鹼對。
基本介紹
- 中文名:共軛酸鹼對
- 外文名:conjugate acid-base pairs
- 概念:因質子得失而相互轉變的一對酸鹼
- 理論:布朗斯特德和勞萊的酸鹼質子理論
- 套用:緩衝溶液
- 學科:無機及分析化學
酸鹼質子理論
共軛酸鹼對
在緩衝溶液中















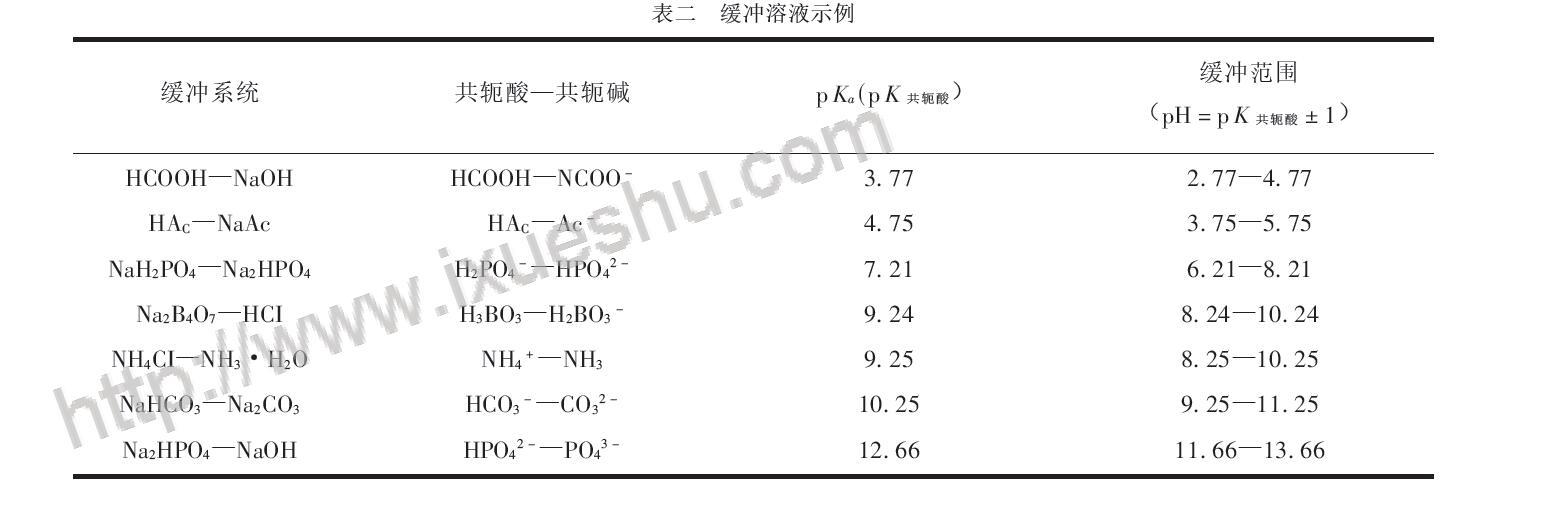 緩衝溶劑示例
緩衝溶劑示例
質子理論闡述,能給出質子的分子或離子是酸,能接受質子的分子或離子是鹼,酸給出質子轉變為相應的鹼,鹼接受質子轉變為相應的酸,這種因質子得失而相互轉變的一對酸鹼稱為共軛酸鹼對。















 緩衝溶劑示例
緩衝溶劑示例出質子的分子或離子是酸,能接受質子的分子或離子是鹼,酸給出質子轉變為相應的鹼,鹼接受質子轉變為相應的酸,這種因質子得失而相互轉變的一對酸鹼稱為共軛酸鹼對。...
根據現代無機化學的定義:凡是能給出質子的物質都是酸,凡是能與質子結合的物質都是鹼,酸與鹼之間的這種關係稱為酸鹼共軛關係,相對應的酸鹼稱為共軛酸鹼。...
酸放出質子後形成的鹼,叫做該酸的共軛鹼;鹼接受質子後形成的酸,叫做該鹼的共軛酸。我們把相差一個質子的對應酸鹼,叫做共軛酸鹼對。中文...
酸鹼反應實際上是酸、鹼之間的質子傳遞反應,其反應方向總是較強酸和較強鹼反應向著生成較弱酸和較弱鹼的方向進行。酸鹼反應的實質是兩個共軛酸鹼對競爭質子的反應。...
根據酸鹼的質子理論,容易放出質子(H+)的物質是強酸,而該物質放出質子後就不容易形成鹼,同質子結合能力弱,因而是弱的鹼。換言之,酸越強,它的共軛鹼就越弱;...
從緩衝作用的原理可知,緩衝溶液一般由具有足夠濃度及適當比例的共軛酸鹼對組成。組成緩衝溶液的共軛酸鹼對的兩種物質合稱為緩衝對(buffer pair)。...
共軛酸鹼的強度次序酸性增強 共軛酸(HB) Ka(在水中) pKa(在水中) 共軛鹼(B)鹼性增強H3O+ H2O H2C2O4 5.4×10-2 1.27 HC2O-4 H2SO3 1.54×10 1.81 ...
在上式中,酸和其對應的共軛鹼為一組共軛酸鹼對。而鹼和其對應的共軛酸也是一組共軛酸鹼對。從平衡觀點看,弱酸的共軛鹼是強鹼,強酸的共軛鹼是弱鹼,因此依據平衡...
緩衝溶液指的是由弱酸及其鹽、弱鹼及其鹽組成的混合溶液,能在一定程度上抵消、減輕外加強酸或強鹼對溶液酸鹼度的影響,從而保持溶液的pH值相對穩定。...
當一個分子或離子釋放氫離子,同時一定有另一個分子或離子接受氫離子,因此酸和鹼會成對出現。酸鹼質子理論可以用以下反應式說明:酸+ 鹼 ⇌ 共軛鹼 + 共軛酸 ...
而弱酸或弱鹼鹽(弱鹽)則會根據共軛酸鹼對而產生不同的氣味(例如醋酸鹽則會有醋酸的味道,氰化氫則會有苦杏仁味等),此外弱酸或弱鹼鹽還會揮發和分解,並且由於水解...
▪ 汞 ▪ 共沉澱 ▪ 共軛二烯烴 ▪ 共軛雙鍵 ▪ 共軛酸鹼對 ▪ 共軛酸鹼對 ▪ 共軛體系 ▪ 共軛效應 ▪ 共價鍵 ▪ 共價鍵 ▪ 共性 ...
5.1酸鹼質子理論1365.1.1酸鹼定義1375.1.2酸鹼的共軛關係和共軛酸鹼對1375.1.3酸鹼反應的實質1385.1.4水的離子積和pH1395.1.5酸鹼水溶液中的質子轉移...
一、酸鹼電離理論109二、酸鹼質子理論109三、酸鹼電子理論110四、軟硬酸鹼理論110第二節弱酸、弱鹼的解離平衡111一、共軛酸鹼對的Ka與Kb的關係111...
第四章酸鹼滴定法38第一節酸鹼反應及其平衡常數38一、酸鹼反應及其實質38二、酸鹼反應的平衡常數以及共軛酸鹼對Ka與Kb的關係39第二節酸鹼溶液中各型體的分布係數與...
滴定分析概述和酸鹼滴定、分光光度法簡述、分析過程;有機篇包括有機化合物的...3.3.1 酸鹼的定義3.3.2 酸鹼反應的實質3.3.3 共軛酸鹼對與酸鹼離解常數...
第二章 酸鹼漓定法32. 什麼叫酸鹼滴定法?33. 酸鹼滴定反應有什麼特點?34. 什麼叫酸鹼質子理論?35. 什麼叫共軛酸鹼對?有什麼特點?...
5.1.5酸鹼的強度1395.1.6共軛酸鹼對中Ka和Kb的關係1405.2酸鹼平衡1415.2.1溶液中酸鹼平衡的處理方法1415.2.2溶液中弱酸、弱鹼的解離平衡142...
三、 共軛酸鹼對的Ka和Kb的關係20 四、 酸和鹼的強度21 §3不同pH溶液中弱酸(鹼)各種型體的分布22 一、 分析濃度與平衡濃度22 二、 不同pH溶液中酸(鹼)...
第一節酸鹼質子理論 一、酸鹼的定義 二、酸鹼反應 第二節水溶液中的酸鹼平衡 一、水的質子自遞反應 二、酸鹼離解平衡 三、共軛酸鹼對的Ka和Kb的關係...
5 2 4共軛酸鹼對的Ka與Kb的關係58 [1] 5 3酸鹼緩衝溶液595 3 1酸鹼緩衝溶液的作用原理605 3 2酸鹼緩衝溶液的pH計算605 3 3緩衝容量和緩衝範圍61...
一、酸鹼解離理論147二、酸鹼質子理論148第二節酸鹼在水溶液中的解離平衡149一、一元弱酸、弱鹼的解離平衡149二、水的解離平衡151三、共軛酸鹼對Ka和Kb的關係151...
