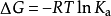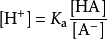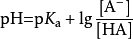基本介紹
- 中文名:酸度係數
- 外文名:Acidity coefficient;pKa
- 別名:pKa酸度係數;酸離解常數;
- 代號:Ka值
數值定義,影響因素,區別聯繫,套用,緩衝溶液,生物化學,數值例舉,
數值定義
影響因素
酸的電離反應通式為: 。
。

從定性角度分析,則可以通過下面的理論粗略比較酸中鍵能大小判斷酸的酸性強弱:
結合上面的理論,使用鮑林規則可以半定量地判斷含氧酸的pKa,其理論是:多元含氧酸逐級電離常數之比約為10-5,即pKa差值為5;含氧酸的pKa與非羥基氧數量(N)有關,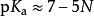 。由此可判斷,無非羥基氧的酸為弱酸,有一個的為中強酸,兩個或三個的為強酸。
。由此可判斷,無非羥基氧的酸為弱酸,有一個的為中強酸,兩個或三個的為強酸。
含氧酸的中心原子R對其酸性有著重要影響,R的半徑越小,電負性越大,氧化數越高,則R吸引電子的能力越強,降低了-OH上的電子云密度,使其容易電離。這個規則稱為R-O-H規則。使用離子勢可以半定量地判斷含氧酸的酸性大小,其計算公式為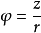 ,其中z為中心陽離子電荷,r為中心陽離子半徑。離子勢反映了中心原子的極化作用強弱,離子勢越高,酸性越強。
,其中z為中心陽離子電荷,r為中心陽離子半徑。離子勢反映了中心原子的極化作用強弱,離子勢越高,酸性越強。
分子的異構現象亦可對pKa造成影響。例如反丁烯二酸與順丁烯二酸的分子結構幾乎完全相同,只是前者為反式結構,後者為順式結構。順丁烯二酸在一級電離時由於形成氫鍵,而使它比反丁烯二酸容易電離,二級電離時由於破壞氫鍵,使得它比反丁烯二酸難電離。
氫鍵也會對pKa有一定影響,例如前面所提到的氟化氫,其成為弱酸的原因不僅在於H-F鍵能相對較大,還在於其電離後由氫鍵形成了穩定的離子對,不能完全發揮出酸的作用。
區別聯繫
由於Ka與Kb的積是一常數,較強的酸即代表較弱的共軛鹼;較弱的酸,則代表較強的共軛鹼。
套用
- 判斷質子溶劑中酸鹼反應的方向與程度,如強酸制弱酸,弱酸制更弱酸等。
- 判斷一種質子酸(可以電離出H+的酸)在一種質子溶劑(可結合H+的溶劑)中是否電離完全。若一種酸的pKa小於溶劑化質子(溶劑的共軛酸)的pKa,則這種酸在此溶液中可以視作完全電離。
- 計算酸溶液的pH值、共軛鹼的強度等。
- 計算出緩衝溶液的pH值,在亨德森-哈塞爾巴爾赫方程亦可得出以上結論。
緩衝溶液
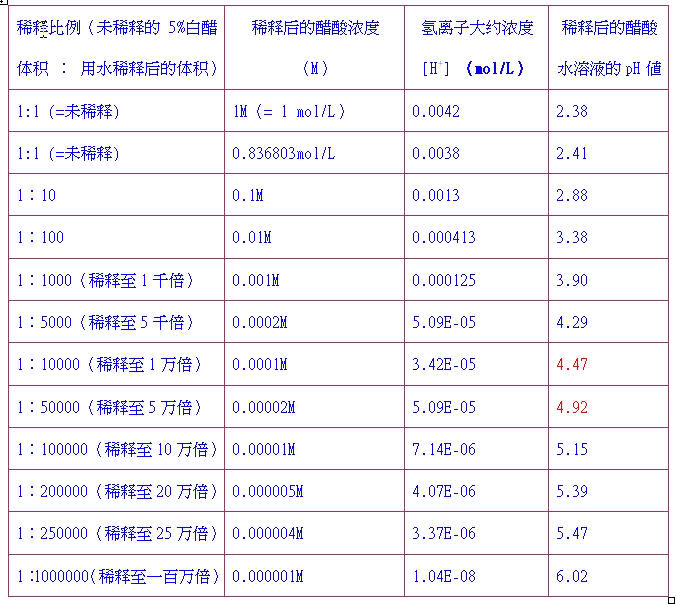
如果緩衝溶液中弱酸濃度與其酸根離子濃度相等,則:pH=pKa,由此可看出,緩衝溶液的pH值不受稀釋所影響,然而這個結論是在忽略水的電離下得出的,如果稀釋足夠倍數,其最終結果仍是趨於pH=7。由此公式,可通過滴定來測量弱酸的酸度係數:將弱酸恰好中和至一半,此時溶液的pH即為弱酸的pKa。
根據此式可得出下列幾點結論:
- 酸和鹽濃度等比例增減時,溶液的pH值不變;
- 酸和鹽濃度相等時,緩衝液的緩衝效率為最高,比例相差越大,緩衝效率越低,緩衝液的一般有效緩衝範圍為pH=pKa±1,pOH=pKb±1。
生物化學
由於蛋白質及胺基酸均具有酸鹼的性質,因此在生物化學中,pKa被用於生理機能的研究。例如,蛋白質及其胺基酸側鏈對酶的活性及蛋白質的穩定性具有重要影響。
數值例舉
| pKa | 名稱 | 化學式/結構式 |
|---|---|---|
- 31.30 | H[SbF6] | |
- 19.20 | HSO3F·SbF5 | |
- 18.00 | ||
- 15.10 | HSO3F | |
- 10.00 | HClO4 | |
- 10.00 | HI | |
- 9.00 | ||
- 8.00 | 鹽酸 | |
- 3.00 | 硫酸 | H2SO4 |
- 2.00 | HNO3 | |
- 1.76 | H3O+ | |
0.27 | 肼* | H3N-NH32+ |
0.804 | HIO3 | |
0.91 | H4P2O7 | |
1.271 | HOOCCOOH | |
1.64 | H5IO6 | |
1.89 | H2SO3 | |
1.99 | 硫酸氫根 | HSO4- |
1.99 | ||
2.148 | 磷酸 | H3PO4 |
2.26 | H3AsO4 | |
3.128 | 檸檬酸 | |
3.14 | 亞硝酸 | HNO2 |
3.20 | HF | |
3.46 | HCNO | |
3.751 | HCOOH | |
3.858 | 乳酸 | |
4.04 | 抗壞血酸(維生素C) | |
4.19 | HOOCCH2CH2COOH | |
4.20 | PhCOOH | |
4.62 | 疊氮酸 | HN3 |
4.60 | 苯胺* | PhNH3+ |
4.756 | 乙酸 | CH3COOH |
4.761 | 檸檬酸二氫根離子 | |
5.17 | 吡啶* | PyH+ |
6.352 | 碳酸** | H2CO3 |
6.40 | 檸檬酸一氫根離子 | |
6.97 | H2S | |
6.99 | 乙二胺* | H2NCH2CH2NH2 |
7.00 | 咪唑*(作為酸) | |
7.198 | 磷酸二氫根 | H2PO4- |
7.205 | 亞硫酸氫根 | HSO3- |
7.537 | HOCl | |
8.55 | HOBr | |
9.236 | B(OH)3 | |
9.246 | 銨 | NH4+ |
9.21 | HCN | |
9.33 | 苯甲胺* | |
9.60 | Si(OH)4 | |
9.81 | 三甲胺* | Me3NH+ |
9.99 | ArOH | |
10.08 | 乙二胺* | |
10.329 | HCO3- | |
10.5 | HOI | |
10.62 | 甲胺* | MeNH3+ |
10.63 | 乙胺* | EtNH3+ |
10.77 | 二甲胺* | Me2NH2+ |
10.80 | 二乙胺* | Et2NH2+ |
11.01 | 三乙胺* | Et3NH+ |
11.64 | H2O2 | |
12.32 | 磷酸一氫根離子 | HPO42- |
12.50 | 胍* | |
12.90 | 硫氫根 | HS- |
14.58 | 咪唑(作為鹼) | |
33 | 氨 | NH3 |
26.00 | 六甲基二矽基胺基鉀(KHMDS) | |
37.00 | 四甲基哌啶鋰(LiTMP) | |
37.00 | 二異丙基胺基鋰(LDA) | |
45.00 | CH3CH2CH3 | |
50.00 | CH3CH3 |
*銨及胺類物質的數據是其接受質子後形成的銨鹽的pKa;
**碳酸的pKa在計算時按碳酸的實際濃度計算,若假定溶液中所有CO2均轉化為碳酸,則其pKa=3.75。