基本信息
名稱: 人工合成基因
主題詞或關鍵字: 人工合成 基因 生命科學 酶
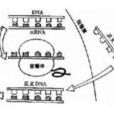
基因合成是指在體外人工合成雙鏈DNA分子的技術,與寡核苷酸合成有所不同:寡核苷酸是單鏈的,所能合成的最長片段僅為100nt左右,而基因合成則為雙鏈DNA分子合成,所能合成的長度範圍50bp-12 kb。
基因工程
誕生
(一)基因工程的概念
基因工程是指按照人們的願望,進行嚴格的設計,通過體外DNA重組和
轉基因技術,賦予生物以新的
遺傳特性,創造出更符合人們需要的新的生物類型和生物產品。基因工程是在DNA分子水平上進行設計和施工的,又叫做DNA重組技術。
原理及技術
原理:基因重組
技術:(一)基因工程的基本工具
(2)功能:能夠識別雙鏈DNA分子的某種特定的
核苷酸序列,並且使每一條鏈中特定部位的兩個核苷酸之間的
磷酸二酯鍵斷開,因此具有
專一性。
(3)結果:經限制酶切割產生的DNA片段末端通常有兩種形式:
黏性末端和平末端。
2.“分子縫合針”——DNA連線酶
(1)兩種DNA連線酶(E.coliDNA連線酶和T4DNA連線酶)的比較:
②區別:E.coliDNA連線酶來源於大腸桿菌,T4DNA連線酶來源於T4噬菌體,只能將雙鏈DNA片段互補的黏性末端之間的磷酸二酯鍵連線起來;而T4DNA連線酶能縫合兩種末端,但連線平末端的之間的效率較低。
(2)與DNA聚合酶作用的異同:DNA聚合酶只能將單個
核苷酸加到已有的核苷酸片段的末端,形成
磷酸二酯鍵。DNA連線酶是連線兩個DNA片段的末端,形成
磷酸二酯鍵。
(1)載體具備的條件:①能在受體細胞中複製並穩定保存。②具有一至多個限制酶切點,供外源DNA片段插入。③具有
標記基因,供重組DNA的鑑定和選擇。
(2)最常用的
載體是質粒,它是一種裸露的、結構簡單的、獨立於
細菌染色體之外,並具有
自我複製能力的雙鏈環狀DNA分子。
(3)其它載體: 噬菌體的衍生物、動植物病毒。
操作程式
第一步:目的基因的獲取
2.
原核基因採取直接分離獲得,
真核基因是人工合成。人工合成目的基因的常用方法有反轉錄法和化學合成法。
3.PCR技術擴增目的基因
(1)原理:DNA雙鏈複製
(2)過程:第一步:加熱至90~95℃DNA解鏈;第二步:冷卻到55~60℃,
引物結合到互補DNA鏈;第三步:加熱至70~75℃,熱穩定DNA聚合酶從引物起始
互補鏈的合成。
1.目的:使目的基因在受體細胞中穩定存在,並且可以遺傳至下一代,使目的基因能夠表達和發揮作用。
(1)
啟動子:是一段有特殊結構的DNA片段,位於基因的首端,是RNA聚合酶識別和結合的部位,能驅動
基因轉錄出mRNA,最終獲得所需的蛋白質。
(2)
終止子:也是一段有特殊結構的DNA片段 ,位於基因的尾端。
(3)
標記基因的作用:是為了鑑定受體細胞中是否含有
目的基因,從而將含有目的基因的細胞篩選出來。常用的
標記基因是抗生素基因。
第三步:將目的基因導入受體細胞
1.轉化的概念:是目的基因進入受體細胞內,並且在受體細胞內維持穩定和表達的過程。
2.常用的轉化方法:
將目的基因導入植物細胞:採用最多的方法是 農桿菌轉化法,其次還有基因槍法和花粉管通道法等。
將目的基因導入動物細胞:最常用的方法是
顯微注射技術。此方法的受體細胞多是受精卵。
將目的基因導入微生物細胞:感受態細胞吸收法
1.首先要檢測 轉基因生物的染色體DNA上是否插入了目的基因,方法是採用DNA分子雜交技術。
2.其次還要檢測 目的基因是否轉錄出了mRNA,方法是採用標記的目的基因作探針與mRNA雜交。
3.最後檢測 目的基因是否翻譯成蛋白質,方法是從轉基因生物中提取蛋白質,用相應的抗體進行 抗原-抗體雜交。
4.有時還需進行個體生物學水平的鑑定。如轉基因抗蟲植物是否出現抗蟲性狀。
套用
1.植物基因工程:抗蟲、抗病、抗逆轉基因植物,利用轉基因改良植物的品質。
2.動物基因工程:提高動物生長速度、改善畜產品品質、用轉基因動物生產藥物。
3.基因治療:把正常的外源基因導入病人體內,使該
基因表達產物發揮作用。
蛋白質工程
蛋白質工程是指以蛋白質分子的結構規律及其生物功能的關係作為基礎,通過基因修飾或基因合成,對現有蛋白質進行改造,或製造一種新的蛋白質,以滿足人類的生產和生活的需求。(基因工程在原則上只能生產
自然界已存在的蛋白質)(1)蛋白質工程崛起的緣由:基因工程只能生產自然界已存在的蛋白質
(2)蛋白質工程的基本原理:它可以根據人的需求來設計蛋白質的結構,又稱為第二代的基因工程。
基本途徑:從預期的蛋白質功能出發,設計預期的
蛋白質結構,推測應有的胺基酸序列,找到相對應的脫氧核苷酸序列(基因)以上是蛋白質工程特有的途徑;以下按照基因工程的一般步驟進行。(注意:目的基因只能用人工合成的方法)
設計中的困難:如何推測非編碼區以及內含子的脫氧核苷酸序列
雜合質粒
1974年,科恩把金黃色萄葡球菌的質粒(上面具有抗青黴素的基因)和大腸桿菌的質粒“組裝”成“雜合質粒”,“送入”大腸桿菌體內,使這種大腸桿菌獲得了對青黴素的抗藥性,這說明,金黃色葡萄球菌質粒上的抗青黴素基因,由“雜合質粒”帶到大腸桿菌體內了,更重要的是表明外來基因在大腸桿菌體內同樣也發生作用(專業上稱為表達)。同年,他從非洲爪蟾的DNA上“裁剪”了一段與大腸桿菌的質粒“拼接”,獲得成功,拼接後的質粒帶著非洲爪蟾的基因進入大腸桿菌了,大腸桿菌即產生了非洲爪蟾的
核糖體核糖核酸(rRNA)。科恩又一次成為開創者。兩棲動物的基因能在細菌里發揮作用,也能在細菌里不斷複製的事實告訴人們,基因工程完全可以不受生物種類的限制,而按照人類的意願去拼接基因,創造新的生物,如創造繅絲的大腸桿菌、製藥的大腸桿菌等等。當科恩取得了第三次的成功後,他立即以DNA重組技術發明人的身份向美國專利局申報了世界上第一個基因工程的技術專利,成為實施基因工程的第一人。
由科恩首次取得成功的基因工程不僅打破了不同物種在億萬年中形成的
天然屏障,預示著任何不同種類生物的基因都能通過基因工程技術重組到一起。科恩的專利也同樣標誌著人類確實可以根據自己的意願、目的,定向地改造生物的遺傳特性,甚至創造新的生命類型。科恩專利技術引起了全球轟動,在短短几年中,世界上許多國家的上百個實驗室開展了基因工程的研究。
1970年,印度血統的美籍學者科蘭納首次用化學方法人工合成了有77個
核苷酸對的酵母丙氨酸的
結構基因。1972年,巴梯
摩爾、斯派戈爾曼、列捷爾等領導的實驗室各自用
反向轉錄酶合成了家兔和人的
珠蛋白基因,這是首次合成的真核生物基因。1973年,科蘭納再次得手,他合成了具有126個
核苷酸對的大腸桿菌酪氨酸運轉RNA(tRNA)基因。為了使合成的基因能發揮作用,科蘭納等經過三年埋頭苦幹,在1976年8月,終於使大腸桿菌酪氨酸運轉RNA(tRNA)基因順利地轉錄出酪氨酸tRNA。
1977年,美國加利福尼亞大學的博耶,用化學方法合成了人生長激素抑制
因子的基因。人生長激素抑制
因子是人腦、腸管、胰腺中分泌出來的一種
神經激素,它能抑制甲狀腺刺激激素,
促胃液素、胰島素和胰高血糖素的分泌,對肢端肥大症、急性胰腺炎和糖尿病等多種疾病都有醫療價值。之後,博耶將這個人工合成的基因與大腸桿菌
質粒重組,重組DNA在質粒運載下順利地進入大腸桿菌,這個人工合成的基因在大腸桿菌中為博耶製造出5毫克人的生長激素抑制
因子。這5毫克生長激素抑制因子可以說是人造基因獻給博耶的厚禮。如果用傳統的辦法從綿羊中提取5毫克生長激素抑制因子,那就要有50萬個綿羊腦袋。
生物產品
除人生長激素抑制因子外,還有如胰島素、干擾素等,也已可以用基因工程的方法獲得。用基因工程創造新生物的最大優越性是可以在短期內培育出新的生物類型,而且可以由基因工程創造的新
生物生產人們期望的生物產品。
基因細胞
合成基因的細胞
美國科研人員培育出第一個由人工合成
基因組控制的細胞,向人造生命形式邁出了關鍵一步。這幾天來,該成果引起了國際同行的廣泛關注。稱讚者有之,擔心者亦有之。滬上相關領域的專家同樣高度關注,不過態度大多謹慎。他們認為,距離真正的人工合成生命,尚有很遠的路要走。
完成這項研究的,是美國克雷格·文特爾研究所的研究人員。他們選取一種蕈狀支原體,對其基因組進行解碼並複製,產生人造的合成基因組。然後將其移植入另一種山羊支原體內,通過分裂和增生,山羊支原體的細胞逐漸為人造基因所控制,最終成為一種全新的生命。研究小組還計畫用類似技術製造一系列新的
微生物,比如可生產
生物燃料的細菌、可以從空氣中吸收二氧化碳和其他污染物的細菌,或是能製造出合成疫苗所需蛋白質的特殊細菌……
項目的負責人認為,此舉意味著“一個新時代的到來”。也有不少外國專家給出了很高評價,例如,美國拉特格斯大學分子生物學家理察·埃布賴特說:“這是人與自然關係的一個轉折點,歷史上第一次有人創造了一個完整的帶有預定特性的細胞。”史丹福大學生物醫學倫理中心主任戴維·馬格努斯認為,這項研究可能開啟基因工程新紀元。新一期的《經濟學人》雜誌也用封面文章的形式對此進行報導,文章認為,“在某種程度上,這種創造生命的舉動比第一顆核子彈爆炸更能證明人類掌控自然的能力。”
相比之下,國內專家對此的評價更加謹慎。滬上一位從事基因研究的專家認為,其實一直以來人為修改、合成其他生物的部分DNA已經是
基因學、遺傳學領域常用的實驗室手段。此次研究的含金量在於人工合成了基因組,並使其發揮了作用。嚴格來說,這是基於現有技術的一次重大進步,但要說“劃時代意義”,恐怕還談不上。
科幻電影《黑客帝國》里,基因工程技術已經發展到可以人工造出“人類”來。類似的題材,也經常在其他科幻作品中出現。那么首個人造
單細胞生物的出現,是否意味著上述情景正在變成現實,人類從此可以隨心所欲創造新生命?
專家認為,現在還沒到擔憂這一點的時候。因為此次試驗的對象支原體是目前發現的最小、最簡單的原核生物。它的大小介於細胞和病毒之間,內部結構很簡單,唯一可見的細胞器是核糖體,這是細胞內
蛋白質合成的
分子機器。蛋白質是根據
基因信息合成的,支原體的蛋白質數量大約有上百個,而人體細胞的蛋白質數以萬計。無論是從DNA鹼基對數量、蛋白質數量還是
細胞結構角度,最簡單的支原體和最複雜的
生命形式———人,兩者之間有雲泥之別,人工合成支原體的成功,並不能推導出合成“人”。
對於“
人造生命”的定義,業內也有不同看法。國外有專家認為,該研究並未跨越“無中生有、創造生命”的界限,只是一個帶有人造基因組的生物體,而非人造生物體。滬上一位不願意透露姓名的專家認為,人造生命應該是由人造DNA和人造蛋白質“組裝”而成。以人類目前掌握的科學知識和技術手段,距離這一步還非常遙遠。
儘管對該研究的評價高低不一,但對相關技術加強監管,卻已成為國際共識。有訊息稱,美國總統歐巴馬已在第一時間致信生物倫理問題專家,要求評估這類研究在醫學、環境、安全等領域的影響;國外的激進團體則警告,當心從此打開“潘多拉魔盒”。滬上專家認為,儘管該技術目前不具備推廣價值,但對其“
不可控因素”應儘早引起重視。一旦某些非法集團掌握相關技術,製造出新的有害微生物和其他生物武器,後果不堪構想。
事實上,近年來,克隆技術、
幹細胞技術和基因工程等飛速發展,由此引發的倫理和道德之爭從未止息。復旦大學生命科學學院細胞學教授吳超群認為,對待此類問題最重要的是“理性”,一味稱讚和過度緊張皆非明智之舉。其實,我國對於
轉基因技術“扶持+控制”的思路很值得借鑑。為了防止
轉基因作物因生物優勢對傳統作物造成擠壓和排斥,我國嚴格劃定了轉基因作物的種植範圍,從而保護了生物品種的
多樣性。
該研究引發的更深層次倫理爭議在於哲學層面。當人類成為和大自然並駕齊驅的“造物主”,創造出自然世界中本身不存在的DNA、進而創造全新生命,人類究竟該如何看待自身在
宇宙中的位置?如果說,合理套用尚有措施可控,那么這些關乎人類存在本質的終極命題,將在更廣範圍內引起討論。