基本介紹
- 中文名:沉澱平衡常數
- 外文名:solubility product constant
- 別稱:溶度積
- 類型:特殊的動態平衡
- 涉及學科:無機化學
- 原理:難溶電解質在水中特殊的動態平衡
溶度積
溶解度關係
溶度積規則

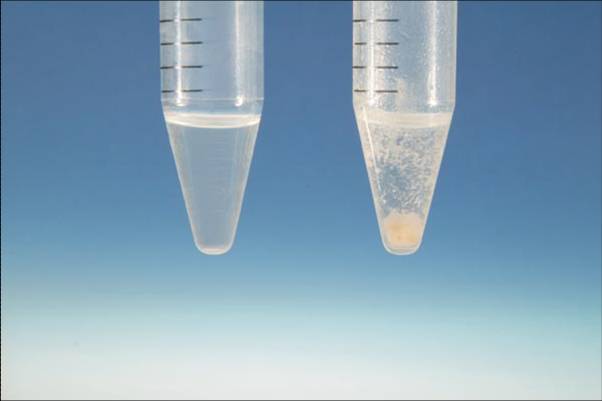

Ksp沉澱平衡常數 (solubility product)Ksp簡稱溶度積.難溶電解質在水中會建立一種特殊的動態平衡。難溶電解質儘管難溶,但還是有一部分陰陽離子進入溶液,同時進入...
Ksp58通用機槍(瑞典語:Kulspruta 58;解作“機槍58”)是由瑞典佛倫內德飛比斯福肯-卡爾古斯塔夫公司(英語:FFV-Carl Gustaf)特許生產的FN MAG(法語:Mitrailleuse d`...
Ksp58B機槍是一款具有消焰器的凹槽機槍。...... Ksp58B機槍是一款具有消焰器的凹槽機槍。中文名 Ksp58B機槍 槍管長度 530 mm 理論射速 650--1100 rpm 類...
KSPATMOS是HI-END全景聲音頻整體解決方案系統,同時集研發、設計、系統及環境集成為一體的全景聲還聲系統。...
它是瑞典生產的Ksp 58B的改進型號,瑞典人獨立改進的。這個版本的正式名稱是 Kulspruta 58D Försök (Ksp-58DF) Försök代表“實驗”...
Ksp沉澱平衡常數 (solubility product)Ksp簡稱溶度積.難溶電解質在水中會建立一種特殊的動態平衡。難溶電解質儘管難溶,但還是有一部分陰陽離子進入溶液,同時進入...
《KSP軌道計算器》是一款其他軟體類的軟體,支持Android 2.3.3。...... 《KSP軌道計算器》是一款其他軟體類的軟體,支持Android 2.3.3。軟體名稱 KSP軌道計算器 ...
坎巴拉太空計畫(Kerbal Space Program、KSP,又稱坎貝爾太空計畫)是由Squad開發的一款使用Unity3D引擎,擁有極高自由度的沙盒風格航空航天模擬遊戲。於2015年4月27日...
1. IP=Ksp 表示溶液是飽和的。這時溶液中的沉澱與溶解達到動態平衡,既無沉澱析出又無沉澱溶解。2. IP<Ksp 表示溶液是不飽和的。溶液無沉澱析出,若加入難溶電解...
終點前:Ag++Cl-=AgCl(白色)Ksp=1.8×10ˉ10終點時:2Ag++CrO42-=Ag2CrO4ˉ(磚紅色)Ksp=2.0×10ˉ12沉澱的溶解度S:SAgCl...
②Kspθ不受離子濃度的影響,而溶解度則不同。③用Kspθ比較難溶電解質的溶解性能只能在相同類型化合物之間進行,溶解度則比較直觀。...
Aurora/Ksp 極光激酶/對紡錘體驅動蛋白 MAPK 促分裂素原活化蛋白激酶 PI3K/Akt/mTOR 細胞的凋亡存活增殖及血管生成 Hormone 荷爾蒙 Integrase/CCR5 整合酶/細...
物流企業的KSP供應鏈管理平台 廈門荊藝軟體有限公司(Kinnsoft)是中國一家從事物流供應鏈管理領域信息技術套用研究和軟體開發的企業,公司成立於1994年,總部位於福建省廈門...
當Q>Ksp時,溶液為過飽和溶液,平衡往左移動,沉澱析出;當Q<Ksp時,溶液為不飽和溶液,若溶液中仍有沉澱存在,平衡往右移動,沉澱溶解;...
KSP卡斯柏國際是一家先進的智慧型化管理國際物流公司,總部位於世界最大的港口城市-上海。...
蘇州瑞芙臣以生活美容、皮膚美容、衰老中心、面部微雕四大現代醫學美容項目。與瑞士整形美容協會(KSAPS)、歐洲美容外科學會(KSPRS)、瑞士美容...
