兩種含有相同離子的鹽(或酸、鹼)溶於水時,它們的溶解度(或酸度係數)都會降低,這種現象叫做同離子效應。在酸鹼平衡和沉澱溶解平衡中都存在同離子效應。
基本介紹
- 中文名:同離子效應
- 外文名:common ion effect
基本概念
種類和原理
降低原理
溶解度降低
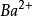
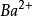

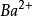


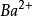



作用
實驗證明
原理
實驗步驟



兩種含有相同離子的鹽(或酸、鹼)溶於水時,它們的溶解度(或酸度係數)都會降低,這種現象叫做同離子效應。在酸鹼平衡和沉澱溶解平衡中都存在同離子效應。

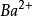


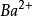




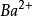


兩種含有相同離子的鹽(或酸、鹼)溶於水時,它們的溶解度(或酸度係數)都會降低,這種現象叫做同離子效應。在酸鹼平衡和沉澱溶解平衡中都存在同離子效應。...
共同離子效應。common-ion effert:弱電解質溶液中加入具有共同離子的強電解質,從而降低弱電解質電離度的現象稱為共同離子效應。同理,在難溶鹽的沉澱平衡中,因...
3.同離子效應:在弱電解質溶液中加入含有與該弱電解質具有相同離子的強電解質,從而使弱電解質的電離平衡朝著生成弱電解質分子的方向移動,弱電解質的解離度降低的...
1 簡介 2 非離子化合物 3 離子化合物 ▪ 同離子效應 ▪ 鹽效應 溶解平衡簡介 編輯 溶解平衡能作用於化合物的套用。溶解的固體可以是共價化合物(有機...
對於影響難溶物質溶解度的因素,重點應掌握同離子效應和酸效應。同離子效應是指在沉澱反應中有餘難溶物質具有共同離子的電解質存在,使難溶物質的溶解度降低的現象。...
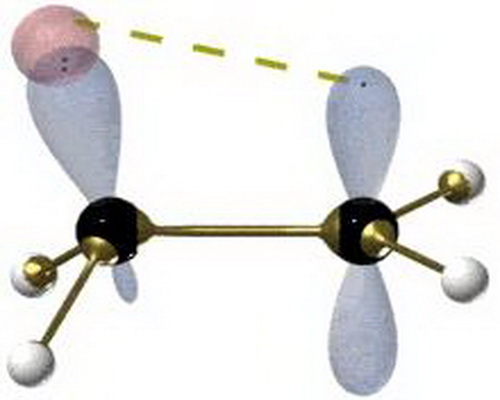
同離子效應指在在難溶電解質飽和溶液中加入與其含有相同離子的易溶強電解質,使難溶電解質的溶解度降低的作用。例如,如果在BaSO4的沉澱溶解平衡系統中加入BaCl2(或...
的強鹼(如NaOH)溶液時,根據同離子效應,忽略弱酸電離出的 ,則溶液中的 整理可得: [1] 意義 解離常數(pKa)是有機化合物非常重要的性質,決定化合物在介質中的...
§5.1.2 同離子效應與異離子效應§5.1.3 沉澱的溶解度與酸度§5.1.4 沉澱的溶解度與絡合作用§5.1.5 影響沉澱溶解度的其它因素§5.2 沉澱的形成和...
5.4.3 同離子效應和鹽效應5.4.4 分步沉澱和沉澱的轉化5.5 現代分離技術簡介5.5.1 固體膜分離技術簡介5.5.2 液膜及氣膜分離技術5.5.3 泡沫分離技術...
依據共軛酸鹼對及其物質的量不同而具有不同的pH值...水合氫離子的濃度取決於弱酸與其共軛鹼的濃度比。當...其主要缺點時溫度效應。這點往往被忽視,在室溫pH是...
而在我國北方和貴州等一些含蒸發岩的碳酸鹽岩分布區,其泉水和地表河水中含有較高的硫酸鈣,同離子效應也促進了鈣華沉積的形成。點擊載入更多...
