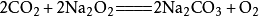研究簡史,分子結構,理化性質,物理性質,化學性質,產生途徑,製備方法,工業製備,實驗室製取,其他製法,主要套用,計算化學數據,安全措施,自然環境方面,人體建康方面,儲存注意事項,相關法規,
研究簡史 原始社會時期,原始人在生活實踐中就感知到了二氧化碳的存在,但由於歷史條件的限制,他們把看不見、摸不著的二氧化碳看成是一種殺生而不留痕跡的凶神妖怪而非一種物質。
公元三世紀,中國西晉時期的
張華 (232年—300年)在所著的《
博物志 》一書記載了一種在燒白石(CaCO
3 )作白灰(CaO)過程中產生的氣體,這種氣體便是如今工業上用作生產二氧化碳的石灰窯氣。
十七世紀初,比利時醫生海爾蒙特(即
揚·巴普蒂斯塔·范·海爾蒙特 ,Jan Baptista van Helmont,1580年—1644年)發現木炭燃燒之後除了產生灰燼外還產生一些看不見、摸不著的物質,並通過實驗證實了這種被他稱為“森林之精”的二氧化碳是一種不助燃的氣體,確認了二氧化碳是一種氣體;還發現燭火在該氣體中會自然熄滅,這是二氧化碳惰性性質的第一次發現。在海爾蒙特之後不久,德國化學家弗里德里希·霍夫曼(Friedrich Hoffmann,1660年—1742年)對被他稱為“礦精(spiritus mineralis)”的二氧化碳氣體進行研究,首次推斷出二氧化碳水溶液具有弱酸性。
1756年,英國化學家
約瑟夫·布萊克 (Joseph Black,1728年—1799年)第一個用定量方法研究了被他稱為“固定空氣”的二氧化碳氣體,二氧化碳在此後一段時間內都被稱作“固定空氣”。
1766年,英國科學家卡文迪許(即
亨利·卡文迪許 ,Henry Cavendish,1731年—1810年)成功地用汞槽法收集到“固定空氣”,並用物理方法測定了其比重及溶解度,還證明了它和動物呼出的和木炭燃燒後產生的氣體相同。
1772年,法國科學家拉瓦錫(即
安托萬-洛朗·拉瓦錫 ,Antoine-Laurent de Lavoisier,1743年—1794年)等用大火鏡聚光加熱放在汞槽上玻罩中的鑽石,發現它會燃燒,而其產物即“固定空氣”。同年,科學家
約瑟夫·普里斯特利 (J.Joseph Priestley,1733年—1804年)研究發酵氣體時發現:壓力有利於被稱為“固定空氣”的二氧化碳在水中的溶解,溫度增高則不利於其溶解。這一發現使得二氧化碳能被套用於人工製造碳酸水(汽水)。
1774年,瑞典化學家
貝格曼 (Torbern Olof Bergman,1735年—1784年)在其論文《研究固定空氣》中敘述了他對“固定空氣”的密度、在水中的溶解性、對石蕊的作用、被鹼吸收的狀況、在空氣中的存在、水溶液對金屬鋅、鐵的溶解作用等的研究成果。
1787年,拉瓦錫在發表的論述中講述將木炭放進氧氣中燃燒後產生的“固定空氣”,肯定了“固定空氣”是由碳和氧組成的,由於它是氣體而改稱為“碳酸氣”。同時,拉瓦錫還測定了它含碳和氧的質量比,碳占23.4503%,氧占76.5497%,首次揭示了二氧化碳的組成。
1797年,英國化學家史密森·坦南特(Smitbson Tennant,1761年—1815年,又譯“台耐特”等)用分析的方法測得被他稱為“固定空氣”的二氧化碳含碳27.65%、含氧72.35%。
1823年,英國科學家法拉第(即
麥可·法拉第 ,Michael Faraday,1791年—1867年)發現加壓可以使二氧化碳氣體液化。同年,法拉第和漢弗萊·戴維(Humphry Davy,1778年—1829年,又譯“笛彼”)首次液化了二氧化碳。
1834年或1835年,德國人蒂羅里爾(即阿德里安·讓·皮埃爾·蒂羅里爾,Adrien-Jean-Pierre Thilorier,1790年—1844年,又譯“蒂洛勒爾”、“狄勞里雅利”、“奇洛列”等)成功地製得固體二氧化碳(乾冰)。
1840年,法國化學家杜馬(即
讓-巴蒂斯特·安德烈·杜馬 ,Jean-Baptiste André Dumas,1800年—1884年)把經過精確稱量的含純粹碳的石墨放進充足的氧氣中燃燒,並且用氫氧化鉀溶液吸收生成的二氧化碳氣體,計算出二氧化碳中氧和碳的質量分數比為72.734:27.266。化學家們結合氧和碳的原子量得出二氧化碳中氧和碳的原子個數簡單的整數比是2:1,又通過實驗(以
阿伏伽德羅 於1811年提出的假說“在同一溫度和壓強下,相同體積的任何氣體都含有相同數目的分子”為依據)測出二氧化碳的分子量為44,從而得出二氧化碳的化學式為CO
2 ,與此化學式相應的名稱便是“二氧化碳”。
1850年,愛爾蘭物理化學家安德魯斯(即
托馬斯·安德魯斯 ,Thomas Andrews,1813年—1885年)開始對二氧化碳的超臨界現象進行研究,並於1869年測定了二氧化碳的兩個臨界參數:超臨界壓強為7.2MPa,超臨界溫度為304.065K(二者在2013年的公認值分別為7.375MPa和303.05K)。
1896年,瑞典化學家阿累尼烏斯(即
斯萬特·奧古斯特·阿累尼烏斯 ,Svante August Arrhenius,1859年—1927年)通過計算指出,大氣中二氧化碳濃度增加一倍,可使地表溫度上升5~6℃。
20世紀50年代初,蘇聯、日本等國學者通過研究成功地將二氧化碳氣體套用於焊接,由此產生了
二氧化碳氣體保護焊 。
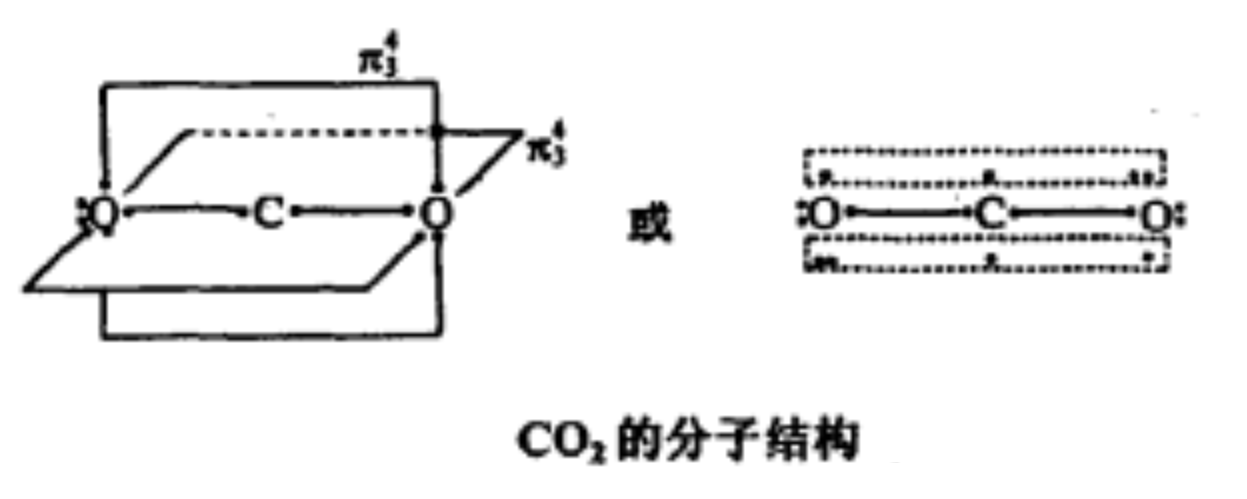
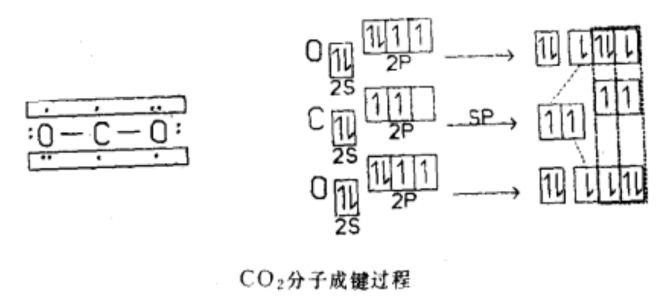
分子結構 CO2 分子形狀是直線形的,其結構曾被認為是:O=C=O。但CO2 分子中碳氧鍵鍵長為116pm,介於碳氧雙鍵(鍵長為124pm)和碳氧三鍵(鍵長為113pm)之間,故CO2 中碳氧鍵具有一定程度的叄鍵特徵。
現代科學家一般認為CO
2 分子的中心原子C原子採取
sp雜化 ,2條sp
雜化軌道 分別與2個O原子的2p軌道(含有一個電子)重疊形成2條
σ鍵 ,C原子上互相垂直的p軌道再分別與2個O原子中平行的p軌道形成2條
大π鍵 。
理化性質 物理性質 二氧化碳在常溫常壓下為無色無味氣體,溶於水和烴類等多數有機溶劑,其相關物理常數如下表:
性質 條件或符號 單位 數據 熔點
攝氏度(℃)
-78.5
沸點
527kPa
攝氏度(℃)
-56.6
相對密度
-79℃,水=1
1.56
相對蒸氣密度
空氣=1
1.53
飽和蒸氣壓
-39℃
千帕(kPa)
1013.25
臨界溫度
攝氏度(℃)
31.3
臨界壓力
兆帕(MPa)
7.39
辛醇/水分配係數
0.83
折射率
12.5~24℃
1.173~1.999
摩爾折射率
6.98
黏度
21℃,5.92MPa
毫帕斯卡秒(mPa·s)
0.0697
蒸發熱
升華
千焦每摩爾(kJ/mol)
25.25
熔化熱
千焦每摩爾(kJ/mol)
8.33
生成熱
千焦每摩爾(kJ/mol)
394.40
比熱容
20℃,定壓
千焦每千克開爾文[kJ/(kg·K)]
2.8448
蒸氣壓
5.9~14.9℃
兆帕(MPa)
4.05~5.07
熱導率
12~30℃
瓦每米開爾文[W/(m·K)]
0.10048~83.74×10-7
體膨脹係數
-50~0℃
每開爾文(K-1 )
0.00495
0~20ºC
每開爾文(K-1 )
0.00991
摩爾體積
毫升每摩爾(mL/mol)
44.7
等張比容
90.2K
60.9
表面張力
達因每厘米(dyne/cm)
3.4
極化率
10-24 cm3
2.76
(參考資料:)
化學性質 二氧化碳是碳氧化合物之一,是一種無機物,不可燃,通常也不支持燃燒,低濃度時無毒性。它也是碳酸的酸酐,屬於酸性氧化物,具有酸性氧化物的通性,其中碳元素的
化合價 為+4價,處於碳元素的最高價態,故二氧化碳具有氧化性而無還原性,但氧化性不強。
1.酸性氧化物的通性
二氧化碳可以溶於水並和水反應生成碳酸,而不穩定的碳酸容易分解成水和二氧化碳,相應的化學反應方程式為:
一定條件下,二氧化碳能與鹼性氧化物反應生成相應的鹽,如:
①與氫氧化鈣反應
向澄清的石灰水中加入二氧化碳,會使澄清的石灰水變渾濁,生成
碳酸鈣 沉澱(此反應常用於檢驗二氧化碳),相應的化學反應方程式為:
由於碳酸氫鈣溶解性大,長時間往已渾濁的石灰水中通入二氧化碳,可發現沉澱漸漸消失。
② 與氫氧化鈉反應
2.弱氧化性
高溫條件下,二氧化碳能與碳單質反應生成
一氧化碳 ,相應的化學反應方程式為:
在點燃的條件下,鎂條能在二氧化碳中燃燒,相應的化學反應方程式為:
鎂在二氧化碳中燃燒 二氧化碳和氫氣在催化劑的作用下會發生生成
甲醇 、一氧化碳和
甲烷 等的一系列反應,其中幾種反應的化學反應方程式為:
二氧化碳的電化學還原是一個利用電能將二氧化碳在電解池陰極還原而將氫氧根離子在電解池陽極氧化為氧氣的過程,由於還原二氧化碳需要的
活化能 較高,這個過程需要加一定高電壓後才能實現,而在陰極發生的氫析出反應的程度隨電壓的增加而加大,會抑制了二氧化碳的還原,故二氧化碳的高效還原需要有合適的催化劑,以致二氧化碳的電化學還原往往是個電催化還原過程。這個過程的簡單機理為:⑴電解池陰極:在初始階段,二氧化碳被吸附在陰極催化劑表面,形成中間產物(反應式①);然後電子在兩個電極間電勢差的作用下發生轉移,轉移數可能是2、4、6、8、12,還原產物隨電子轉移數的不同而可能是一氧化碳、甲酸根、甲酸等(反應式②-④)。⑵電解池陽極:水溶液中發生析氫反應,產生氫氣(反應式⑤、⑥)。
二氧化碳電化學還原反應 3.與過氧化物反應
二氧化碳能與
過氧化鈉 (Na
2 O
2 )反應生成
碳酸鈉 (Na
2 CO
3 )和氧氣(O
2 ),相應的化學反應方程式為:
。
4.與格式試劑反應
在酸性條件下,二氧化碳能和格式試劑在無水乙醚中反應生成羧酸,相應的化學反應方程式為:
說明:式子中R為脂肪烴基或芳香烴基,X為鹵素,Etheranhydrous表示無水乙醚。
5.與環氧化合物的插入反應
二氧化碳可以和環氧化合物在電催化作用下可反應生成環狀碳酸酯,相應的化學反應方程式為:
二氧化碳的插入反應 6.製取金剛石(置換反應)
在440℃(713.15K)和800個大氣壓(約808MPa)的條件下,二氧化碳可與金屬鈉反應生成金剛石,相應的化學反應方程式為:
。
7.光合作用暗反應
二氧化碳參與了光合作用的暗反應,是綠色植物光合作用不可缺少的原料,其參與的反應過程被稱為“二氧化碳的固定”,相應的化學反應方程式為:
產生途徑 自然界中碳循環示意圖 二氧化碳氣體是大氣組成的一部分(占大氣總體積的0.03%-0.04%),在自然界中含量豐富,其產生途徑主要有以下幾種:①有機物(包括動植物)在分解、發酵、腐爛、變質的過程中都可釋放出二氧化碳。②石油、石臘、煤炭、天然氣燃燒過程中,也要釋放出二氧化碳。③石油、煤炭在生產化工產品過程中,也會釋放出二氧化碳。④所有糞便、腐植酸在發酵,熟化的過程中也能釋放出二氧化碳。④所有動物在呼吸過程中,都要吸氧氣吐出二氧化碳。
製備方法 工業製備 高溫煅燒石灰石(或白雲石)過程中產生的二氧化碳氣,經水洗、除雜、壓縮,製得氣體二氧化碳:
生產乙醇發酵過程中產生的二氧化碳氣體,經水洗、除雜、壓縮,製得二氧化碳氣。
氨、氫氣、合成氨生產過程中往往有脫碳(即脫除氣體混合物中二氧化碳)過程,使混合氣體中二氧化碳經加壓吸收、減壓加熱解吸可獲得高純度的二氧化碳氣。
一般以副產物二氧化碳為原料氣,用吸附膨脹法從吸附相提取高純二氧化碳,用低溫泵收集產品;也可採用吸附精餾法製取,吸附精餾法採用矽膠、3A分子篩和活性炭作吸附劑,脫除部分雜質,精餾後可製取高純二氧化碳產品。
由炭窯窯氣和甲醇裂解所得氣體精製而得二氧化碳。
實驗室製取 口訣
實驗室制二氧碳,大理石與稀鹽酸。兩種蘇打皆不用,速度太快控制難。
不用硫酸代鹽酸,鎂鹽不如鈣鹽廉。硝酸見光易分解,驗滿瓶口火不燃。
反套用品
大理石或石灰石(主要成分是CaCO3 (實驗室制二氧碳,大理石與稀鹽酸)
反應原理
製取裝 置
固-液不加熱型(如圖)。
二氧化碳製取裝置 收集方法
由於二氧化碳密度比空氣大,能溶於水且能與水反應,所以採用向上排空氣法。
檢驗方法
將生成的氣體通入澄清的石灰水,石灰水變渾濁,證明該氣體為二氧化碳。
驗滿方法
用燃著的木條被在集氣瓶口(不能伸入瓶內),如果火焰熄滅,證明已集滿。
注意事項
①反應時可能揮發出的
氯化氫 (HCl)氣體,可通過飽和碳酸氫鈉(NaHCO
3 )溶液除去生成氣體中的氯化氫氣體。
②必要時可用裝有濃硫酸的洗氣瓶除去生成氣體中水蒸氣。
③不能用碳酸鈣和
濃鹽酸 反應,原因:濃鹽酸易揮發出大量氯化氫氣體,使碳酸氫鈉無法完全去除,製得的二氧化碳純度會下降。
④在實驗室中是用大理石(CaCO3
⑤不能用Na2 3 3 3 2 3 3 (兩種蘇打皆不用,速度太快控制難)
⑥不能用稀硫酸代替鹽酸,原因:稀硫酸跟大理石(CaCO3 4 (不用硫酸代鹽酸)
⑦不能用MgCO3 3 3 3 3 3 (鎂鹽不如鈣鹽廉)
⑧不能用硝酸代替鹽酸,原因:硝酸見光易分解(
),若用硝酸代替鹽酸,則製得的CO
2 中就會有少量的NO
2 和O
2 。此外,硝酸的價格較鹽酸貴,故通常不用硝酸代替鹽酸。
( 硝酸 見光易分解) ⑨因為二氧化碳能滅火,故可以將燃著的火柴置於集氣瓶口檢驗,若火焰熄滅,則證明二氧化碳已經充滿了集氣瓶。(鑑別火柴不能燃)
將碳酸氫鈉充分乾燥後裝入硬質玻璃管中,在管口處裝填玻璃棉後封閉,用抽氣泵抽真空。然後,加熱使碳酸氫鈉分解。最初發生的二氧化碳可放掉。分解產生的氣體需導入用冰冷卻的導管中,使氣體中的水蒸氣冷凝下來,再將氣體先後導入分別裝有氯化鈣和五氧化二磷的U形管中使其乾燥。100℃時,碳酸氫鈉的分解壓為97.458kPa,120℃時為166.652kPa。
其他製法 小蘇打(主要成分是碳酸氫鈉)和白醋混合在一起時,發生複分解反應,放出二氧化碳氣體,相應的化學反應方程式為:
。
主要套用 高純二氧化碳主要用於電子工業,醫學研究及臨床診斷、二氧化碳雷射器、檢測儀器的校正氣及配製其它特種混台氣,在聚乙烯聚合反應中則用作調節劑。
固態二氧化碳廣泛用於冷藏奶製品、肉類、冷凍食品和其它轉運中易腐敗的食品,在許多工業加工中作為冷凍劑,例如粉碎熱敏材料、橡膠磨光、金屬冷處理、機械零件的收縮裝配、真空冷阱等。
氣態二氧化碳用於碳化軟飲料、水處理工藝的pH控制、化學加工、食品保存、化學和食品加工過程的惰性保護、焊接氣體、植物生長刺激劑,在鑄造中用於硬化模和芯子及用於氣動器件,還套用於殺菌氣的稀釋劑(即用氧化乙烯和二氧化碳的混台氣作為殺菌、殺蟲劑、熏蒸劑,廣泛套用於醫療器具、包裝材料、衣類、毛皮、被褥等的殺菌、骨粉消毒、倉庫、工廠、文物、書籍的熏蒸)。
液體二氧化碳用作致冷劑,飛機、飛彈和電子部件的低溫試驗,提高油井採收率,橡膠磨光以及控制化學反應,也可用作滅火劑。
超臨界狀態的二氧化碳可以用作溶解非極性、非離子型和低分子量化合物的溶劑,所以在均相反應中有廣泛套用。
計算化學數據 疏水參數計算參考值(XlogP)
0.9
氫鍵供體數量
0
氫鍵受體數量
2
可旋轉化學鍵數量
0
互變異構體數量
無
拓撲分子極性表面積
34.1
重原子數量
3
表面電荷
0
複雜度
18.3
同位素原子數量
0
確定原子立構中心數量
0
不確定原子立構中心數量
0
確定化學鍵立構中心數量
0
不確定化學鍵立構中心數量
0
共價鍵單元數量
1
(表格參考資料:)
安全措施 自然環境方面 天然的溫室效應:大氣中的二氧化碳等溫室氣體在強烈吸收地面長波輻射後能向地面輻射出波長更長的長波輻射,對地面起到了保溫作用。
增強的溫室效應:自工業革命以來,由於人類活動排放了大量的二氧化碳等溫室氣體,使得大氣中溫室氣體的濃度急劇升高,結果造成溫室效應日益增強。據統計,工業化以前全球年均大氣二氧化碳濃度為278ppm(1ppm為百萬分之一),而2012年是全球年均大氣二氧化碳濃度為393.1ppm,到2014年4月,北半球大氣中月均二氧化碳濃度首次超過400ppm。
全球氣候變暖:大氣溫室效應的不斷加劇導致全球氣候變暖,產生一系列當今科學不可預測的全球性氣候問題。國際氣候變化經濟學報告中顯示,如果人類一直維持如今的生活方式,到2100年,全球平均氣溫將有50%的可能會上升4℃。如果全球氣溫上升4℃,地球南北極的冰川就會融化,海平面因此將上升,全世界40多個島嶼國家和界人口最集中的沿海大城市都將面臨淹沒的危險,全球數千萬人的生活將會面臨危機,甚至產生全球性的生態平衡紊亂,最終導致全球發生大規模的遷移和衝突。
全球氣候變暖漫畫 低碳生活:儘量減少生活作息時所耗用的能量要,從而減低二氧化碳排放量,減少對大氣的污染,減緩生態惡化。
國際法律:1992年6月在巴西舉行的聯合國環境與發展大會上,有153個國家簽署了《聯合國氣候變化框架公約》,此公約自1994年3月起有效,已有176個締約方(截至2015年2月);1997年12月,由《聯契約氣候變化框架公約》參加國出席的會議在日本京都召開,會議制定了《京都議定書》,作為《聯契約氣候變化框架公約》的補充條款,此條約自2005年2月16日起有效,已有183個締約方(截至2009年2月);2015年11月30日—12月11日,在巴黎舉行的《聯契約氣候變化框架公約》第21次締約方大會暨《京都議定書》第11次締約方大會上,來自195個國家的代表一致通過了《〈聯台國氣候變化框架公約〉巴黎協定》(《巴黎協定》)。
人體建康方面 研究表明,空氣中二氧化碳濃度低於2%時,對人沒有明顯的危害,超過這個濃度則可引起人體呼吸器官損壞,即一般情況下二氧化碳並不是有毒物質,但當空氣中二氧化碳濃度超過一定限度時則會使肌體產生中毒現象,高濃度的二氧化碳則會讓人窒息。動物實驗證明:在含氧量正常(20%)的空氣中,二氧化碳的濃度越高,動物的死亡率也越高。同時,純二氧化碳引起動物死亡較低氧所致的死亡更為迅速。此外,有人認為:在低氧的情況下,8%~10%濃度的二氧化碳即可在短時間內引起人、畜死亡。
中毒原理
高濃度二氧化碳本身具有刺激和麻醉作用且能使肌體發生缺氧窒息。
中毒症狀
輕度:一般出現頭暈、頭痛、肌肉無力、全身酸軟等不適之感。
中度:頭暈將有倒地之勢;胸悶,鼻腔和咽喉疼痛難忍,呼吸緊促,胸部有壓迫及憋氣感;劇烈性頭痛、耳鳴、肌肉無力、皮膚發紅、血壓升高,脈快而強。
重度:突然頭暈無法支持而倒地,憋氣、呼吸困難、心悸、神志不清、昏迷、皮膚口唇和指甲青紫、血壓下降、脈弱至不能觸及,瞳孔散大。對光反射消失,全身鬆軟,聲門擴大,相繼呼吸心跳停止而至死亡,急性期過後有的可留有嗜睡及記憶力減退等症狀。
急救措施
①迅速地使中毒者脫離高濃度的二氧化碳環境,到空氣新鮮處,解松中毒者衣領,人工輔助呼吸以使其儘快吸入氧氣,必要時用高壓氧治療,掄救人員應佩帶有效的呼吸防護器。
②注射呼吸興奮劑,有繼發感染的給予抗生素;二氧化碳結合力下降應靜脈滴注碳酸氫鈉或乳酸鈉;四肢痙摩可以服用較大劑量的鎮靜劑;長期高熱和驚厥可用鎮靜藥物;其它如肺水腫、腦水腫等應對症處理。
預防方法
進入含有較高濃度二氧化碳的工作區域前,檢查空氣中二氧化碳濃度是否超過了2%,若超過,則需要採取有效的安全措施,如:①進行通風排毒,置換工作場所空氣,使空氣中二氧化碳濃度不超過了2%;②佩戴送風面盔、自吸式導管防毒面具、氧氣呼吸器等常用的販毒面具。
儲存注意事項 二氧化碳適宜儲存於陰涼、通風的不燃氣體專用庫房,適合以液態或固態形式裝運。儲存、運輸二氧化碳時需要注意以下幾點:①遠離火種、熱源,庫溫不宜超過30℃;②與易(可)燃物分開存放,切忌混儲;③儲區應備有泄漏應急處理設備。
相關法規 在中國,二氧化碳是2007年4月12日發布、2007年11月1日實施的 《工作場所有害因素職業接觸限值第1部分:化學有害因素》(GBZ 2.1-2007)中的第90種物質,在衛生要求方面,其工作場所中的時間加權平均容許濃度(permissible concentration-time weighted average,PC-TWA)為9000mg/m3 、短時間接觸容許濃度(Permissible concentration-Short Term Exposure Limit,PC-STEL)為18000mg/m3 。此外,與二氧化碳密切相關的國家法規是規定了公共場所空氣中二氧化碳濃度的測定方法的國家標準《公共場所空氣中二氧化碳測定方法》(GB/T 18204.24-2000),此標準已經被2014年9月3日發布、2014年12月1日實施的《公共場所衛生檢驗方法 第2部分:化學污染物》(GB/T 18204.2-2014)代替。對於二氧化碳的檢測,《公共場所衛生檢驗方法 第2部分:化學污染物》推薦採用的標準檢測方式有3種檢測方法,即不分光紅外線氣體分析法(最低檢出濃度為0.01%)、氣相色譜法(最低檢出濃度為0.014%)、容量滴定法(最低檢出濃度為0.001%)。
在美國,美國政府工業衛生學家會議(American Conference OF Governmental Industrial Hygienists,ACGIH)閾值濃度、美國職業安全與健康管理局(Occupational Safety and Health Administration,OSHA)允許濃度值和美國國家職業安全衛生研究所(National Institute for Occupational Safety and Health,NIOSH)推薦濃度值均為5000ppm(5000×10-6 )。

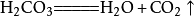

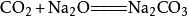
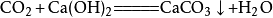

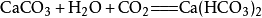
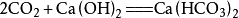
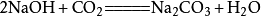
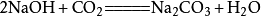
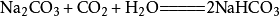
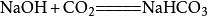

 鎂在二氧化碳中燃燒
鎂在二氧化碳中燃燒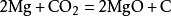


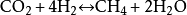
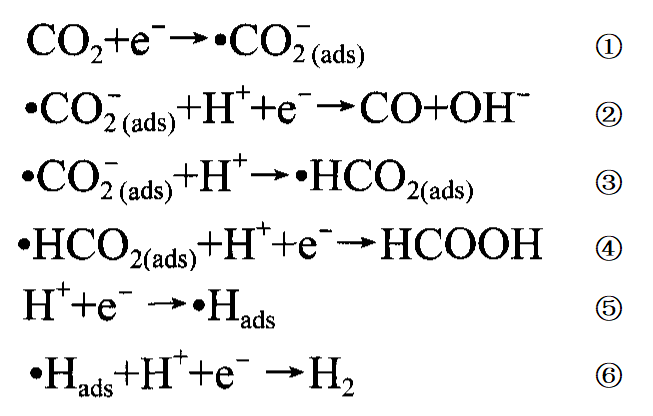 二氧化碳電化學還原反應
二氧化碳電化學還原反應
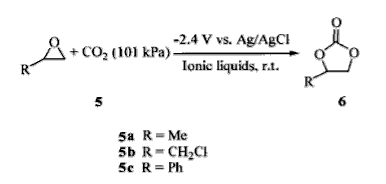 二氧化碳的插入反應
二氧化碳的插入反應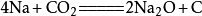
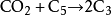
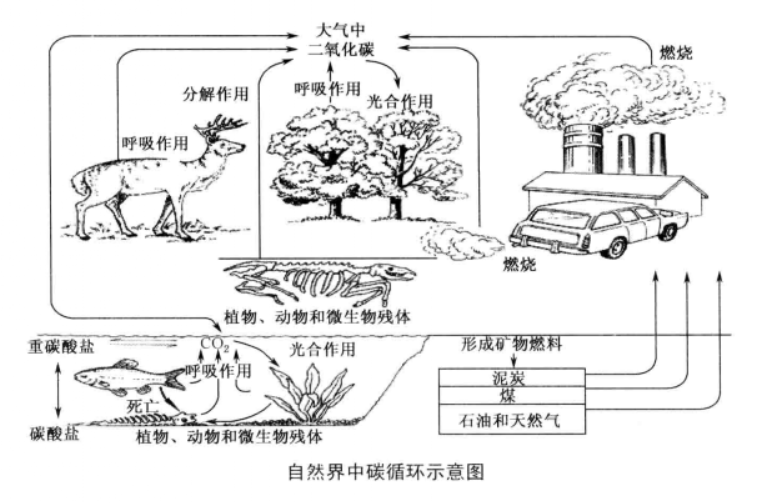 自然界中碳循環示意圖
自然界中碳循環示意圖

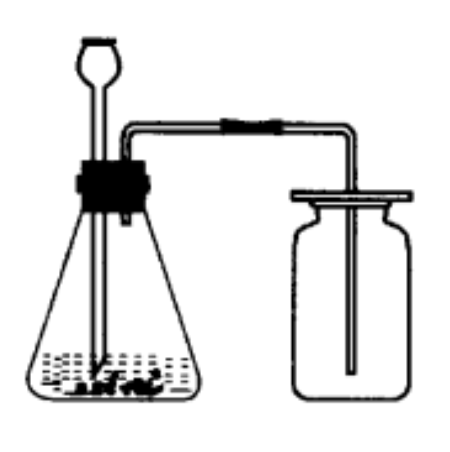 二氧化碳製取裝置
二氧化碳製取裝置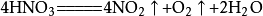
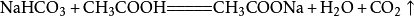
 全球氣候變暖漫畫
全球氣候變暖漫畫