基本介紹
分子結構圖片,特性,歷史,
分子結構圖片
右側圖片為其共軛鹼的分子結構圖片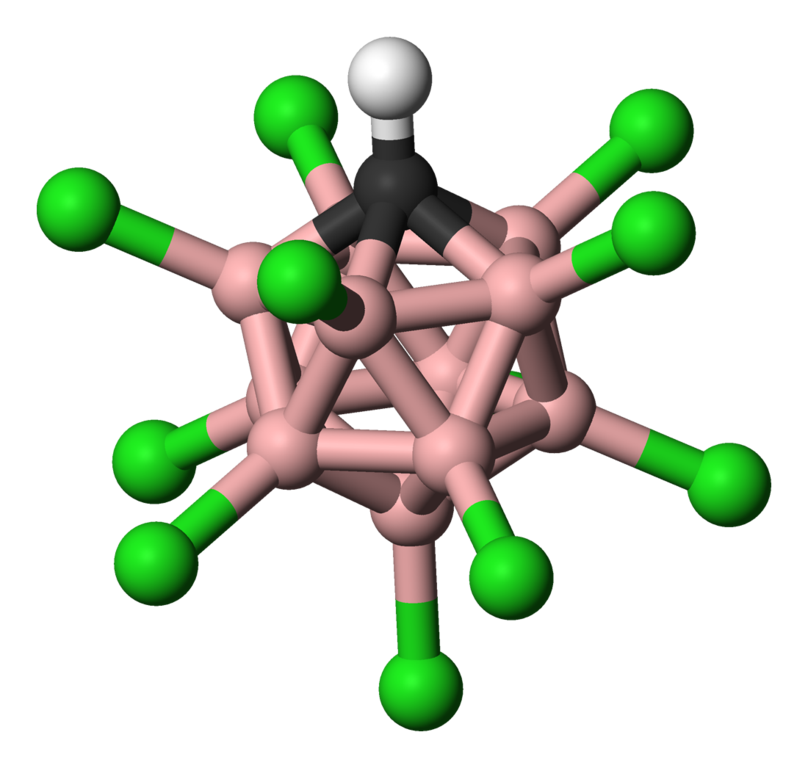 氫-白色 氯-綠色 硼-粉色 碳-黑色
氫-白色 氯-綠色 硼-粉色 碳-黑色
 氫-白色 氯-綠色 硼-粉色 碳-黑色
氫-白色 氯-綠色 硼-粉色 碳-黑色特性
造成碳硼烷酸強酸性的原因,是由於其共軛鹼CHB11Cl11-非常穩定,而且具有高電負性的氯取代基,能有效分散負電荷。而外側的氯包覆碳硼烷核心,使碳硼烷酸根非常穩定,不易與其他化學物質反應。
碳硼烷酸雖然酸性強,但不具強烈的腐蝕性與氧化性。混合酸,如魔酸、氟銻酸的酸性更強,但會生成氟離子造成副反應,生成的氫氟酸(HF)會腐蝕玻璃,造成使用上的困難。氟會攻擊富勒烯(C60),故H(CHB11Cl11)成為已知唯一能質子化富勒烯但不會將其分解的酸,能與富勒烯形成1:1的鹽類。
碳硼烷酸具備令人吃驚的釋放氫離子的能力,酸性是水的一百萬億倍。但由於碳硼烷酸中碳硼烷的結構十分穩定,釋放氫離子後,由11個硼原子和一個碳原子排列而成的20面體結構沒有發生任何變化,不發生進一步的化學反應,因此腐蝕性很低。
歷史
2004年,加州大學河濱校區(UC Riverside)的 Chris Reed 團隊首先合成出碳硼烷酸。
人們對酸的認識是逐漸加深的。硫酸(H2SO4)、鹽酸(HCl)、硝酸(HNO3),被稱為三大強酸,它們可以腐蝕我們日常生活中見到的很多物質。而王水是由濃硝酸和濃鹽酸按1:3的比例混合而成,能夠和化學性質極不活潑的金(Au)發生化學反應。所以在很長的一段時間內,人們認為王水就是酸中之王,是最強的酸了。
後來,奧萊教授和他的學生偶然發現了一種奇特的溶液,它能溶解不溶於當時已知的任何酸的高級烷烴蠟燭,人們才知道其實高氯酸並不是最強的酸,還有比它強的酸,這就是魔酸,又叫超強酸。自從奧萊教授和他的學生髮現超強酸,人們又開始研究起強酸,相繼找到了多種新的超強酸。
在超強酸出現之前,最強的簡單分子結構的酸性物質為三氟甲基磺酸以及氟磺酸,而後發現的超強酸,則多是氟化氫及氟基路易斯酸的混合體系,例如HF(SbF5)n,氟磺酸與五氟化銻混合體系等,這些超強質子酸大多含有氟化氫,可以直接溶解玻璃,無法在玻璃器皿中盛放。而碳硼烷酸則是已知超強酸中第一個可以在玻璃器皿中保存的超強酸性物質。
