基本介紹
- 中文名:滴定曲線
- 屬於:一種表示滴定變化的圖示
- 可分為:兩類
- 曲線呈:S形
酸鹼滴定
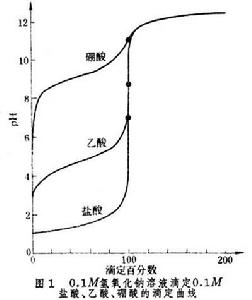 滴定曲線計算
滴定曲線計算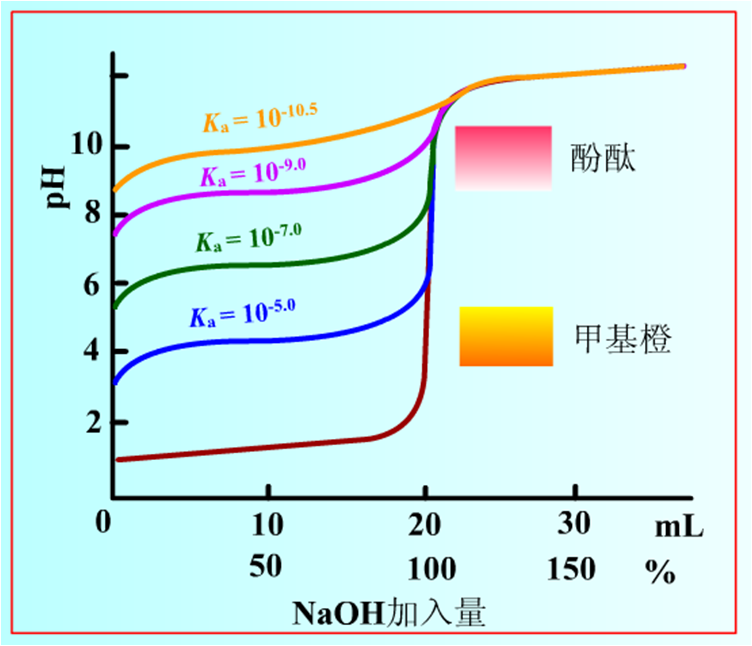
 滴定曲線計算
滴定曲線計算(見容量分析)過程中溶液性質。滴定曲線大致:①用濃度的對數函式表示(如圖1和圖2 中的pH和pZn,p即常用對數的負值)。由曲線等當點附近的變化,可以判定能否用指示...
酸鹼滴定曲線是在酸鹼滴定中如何選擇合適的指示劑來指示滴定終點,需根據滴定曲線來選擇。...
酸鹼滴定法是指利用酸和鹼在水中以質子轉移反應為基礎的滴定分析方法。可用於測定酸、鹼和兩性物質,是一種利用酸鹼反應進行容量分析的方法。用酸作滴定劑可以測定鹼...
電位滴定法(potentiometric titration)是在滴定過程中通過測量電位變化以確定滴定終點的方法,和直接電位法相比,電位滴定法不需要準確的測量電極電位值,因此,溫度、液體...
滴定分析中,當滴定至等當點時,往往沒有任何外觀效果可供判斷,常藉助於指示劑的顏色變化來確定終止滴定,此時指示劑的變色點,即為滴定終點。...
強鹼滴定弱酸是一種化學研究方法。...... 1 強鹼滴定弱酸 2 滴定曲線 強鹼滴定弱酸強鹼滴定弱酸 編輯 滴定開始前(Vb=0) 溶液的[H+]主要來自HAc的離解,pH值按...
電位滴定是利用溶液電位突變指示終點的滴定法。在滴定過程中,被滴定的溶液中插入連線電位計的兩支電極,一支為參比電極,另一支為指標電極。與直接電位法相比,電位...
一般實驗室滴定分析採用的是人工滴定法,它是根據指示劑的顏色變化指示滴定終點,然後目測標準溶液消耗體積,計算分析結果。自動電位滴定法是通過電位的變化,由儀器自動...
化學滴定分析答案、滴定分析法的準確度比較高,其相對誤差約為±0.2%。...... 16、代數法計算滴定曲線時被測的酸(鹼)溶液濃度通常設為___mol·L-1,而被測的...
高頻滴定法,利用幾兆周至幾百兆周高頻電流進行電導滴定的電化學分析法,它與普通的低頻電流的電導滴定(見電導分析法)的主要區別,在於滴定池溶液中沒有電極,而是把...
電位滴定儀是利用電位滴定法在滴定過程中通過測量電位變化以確定滴定終點的方法的儀器。主要用於高等院校、科研機構、石油化工、製藥、藥檢、冶金等各行業的各種成分的...
一.滴定曲線在酸鹼滴定中,隨著滴定劑的加入,溶液的 發生變化,在化學計量點附近,溶液的 PH發生突變,形成滴定突躍.與此相似,在絡合滴定中,隨著滴定劑(EDTA)的加入...
熱量滴定法r}lorimetric lttrAtkUll又稱測溫滴定法[thernwrnetric titzatian )、熱函滴定法(eCtLlta}}imeLriC Liira-tlOIl} n是以滴定過程中產生熱效應為基礎...
將滴定操作與吸光度測量相結合的一種分析方法。...... 同時測定待測溶液體系在適當波長處的吸光度,通過吸光度對滴定劑用量作圖(稱光度滴定曲線)來確定反應終點的方...
