基本介紹
- 中文名:酸鹼滴定法
- 外文名:acid-base titration
- 氫氧化鈉:常用的鹼標準溶液
- 缺點:精確度不高
- 誤差:約為1%
- 學科:無機化學
酸鹼滴定法的基本原理
強酸強鹼的滴定
強鹼滴定弱酸
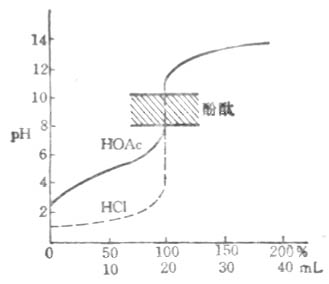 用NaOH滴定HOAc的滴定曲線
用NaOH滴定HOAc的滴定曲線強酸滴定弱鹼
方法簡介
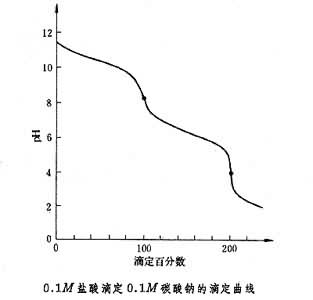 滴定曲線
滴定曲線
 酸鹼滴定法
酸鹼滴定法
 用NaOH滴定HOAc的滴定曲線
用NaOH滴定HOAc的滴定曲線 滴定曲線
滴定曲線
 酸鹼滴定法
酸鹼滴定法酸鹼滴定法是指利用酸和鹼在水中以質子轉移反應為基礎的滴定分析方法。可用於測定酸、鹼和兩性物質,是一種利用酸鹼反應進行容量分析的方法。用酸作滴定劑可以測定鹼...
一般實驗室滴定分析採用的是人工滴定法,它是根據指示劑的顏色變化指示滴定終點,然後目測標準溶液消耗體積,計算分析結果。自動電位滴定法是通過電位的變化,由儀器自動...
滴定分析法,是化學分析法的一種,將一種已知其準確濃度的試劑溶液(稱為標準溶液)滴加到被測物質的溶液中,直到化學反應完全時為止,然後根據所用試劑溶液的濃度和...
比如,氧化還原滴定主要用於氧化還原反應,沉澱滴定主要用於反應中產生沉澱的反應,酸鹼滴定主要用於酸性物質與鹼性物質的反應或者廣義上的路易士酸,而絡合滴定則主要用於...
電位滴定法(potentiometric titration)是在滴定過程中通過測量電位變化以確定滴定終點的方法,和直接電位法相比,電位滴定法不需要準確的測量電極電位值,因此,溫度、液體...
水溶液酸鹼中和法(中和法)亦稱酸鹼滴定法,是以酸鹼中和反應為基礎的容量分析法。...... 以酸鹼中和反應為基礎的容量分析法稱為酸鹼中和法(亦稱酸鹼滴定法)。...
電導滴定法是電化學分析法的一種將標準溶液滴入被測物質的溶液,從電導率的改變而決定終點的方法。能準確地測定溶液中濃度較低的物質,套用範圍與電位滴定法大致相同...
基本介紹 項目編號Plan Name in Chinese 20102273-T-610 中文項目名稱Plan Name in Chinese 碳酸鋰、單水氫氧化鋰、氯化鋰化學分析方法 碳酸鋰量的測定酸鹼滴定法...
基本介紹 項目編號Plan Name in Chinese 20102270-T-610 中文項目名稱Plan Name in Chinese 碳酸鋰、單水氫氧化鋰、氯化鋰化學分析方法 氫氧化鋰量的測定酸鹼滴定...
化學滴定分析答案、滴定分析法的準確度比較高,其相對誤差約為±0.2%。...... 24、磷的酸鹼滴定法測定為什麼能用於微量磷含量的確定?磷的酸鹼滴定法測定過程是:試...
基本介紹 項目編號Plan Name in Chinese 20102259-T-610 中文項目名稱Plan Name in Chinese 碳酸鋰、單水氫氧化鋰、氯化鋰化學分析方法 二氧化碳量的測定酸鹼滴定法...
酸鹼滴定法它是以酸、鹼之間質子傳遞反應為基礎 的一種滴定分析法。可用於測定酸、鹼和兩性物質。其基本反應為配位滴定法它是以配位反應為基礎的一種滴定分析法...
氧化還原滴定法是以溶液中氧化劑和還原劑之間的電子轉移為基礎的一種滴定分析方法。與酸鹼滴定法和配位滴定法相比較,氧化還原滴定法套用非常廣泛,它不僅可用於無機...
滴定分析方法是化學分析的主要方法之一,又稱容量分析法。該法是將一種已知準確濃度的試劑溶液(標準溶液),由滴定管滴加到被測物質的溶液中,直到所加入的試劑與被...
滴定量熱法也稱熱滴定法或測溫滴定法。是一種量熱或分析技術,即用一種反應物滴定另一種反應物,隨著加入滴定劑的數量的變化,測量反應體系溫度的變化。滴定一般在...
利用溶液四大平衡:酸鹼(電離)平衡、氧化還原平衡、絡合(配位)平衡、沉澱溶解平衡。滴定分析根據其反應類型的不同,可將其分為:1、酸鹼滴定法:測各類酸鹼的酸鹼度...
