強鹼滴定弱酸是一種化學研究方法。
基本介紹
- 中文名:強鹼滴定弱酸
- 類型:實驗
- 隸屬:化學類
- 缺點:人與人之間誤差較大
- 公式:pOH=4.30 pH=9.70
強鹼滴定弱酸
- 滴定開始前(Vb=0) 溶液的[H+]主要來自HAc的離解,pH值按最簡式計算:
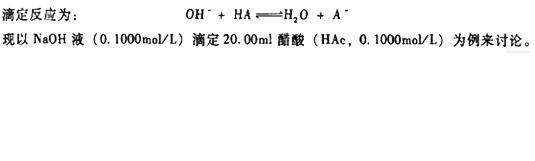
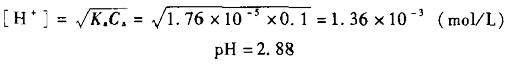 1
1 2
2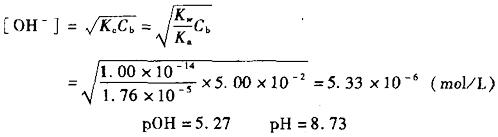 3
3強鹼滴定弱酸是一種化學研究方法。

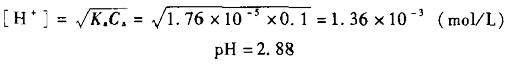 1
1 2
2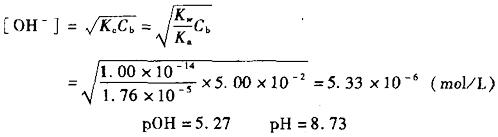 3
3強鹼滴定弱酸是一種化學研究方法。...... 強鹼滴定弱酸強鹼滴定弱酸 編輯 滴定開始前(Vb=0) 溶液的[H+]主要來自HAc的離解,pH值按最簡式計算: ...
酸鹼中和和滴定指示劑的選擇之二:為了減小方法誤差,使滴定終點和等當點重合,需要選擇適當的指示劑。強酸與弱鹼相互滴定時,應選用甲基橙。強鹼與弱酸相互滴定時,應...
酸鹼滴定法強鹼滴定弱酸 滴定反應為:以NaOH液(0.1000moL/L滴定20.00ml醋酸(HAc,0.1000mol/L) 用NaOH滴定HOAc的滴定曲線 為例,滴定曲線如下圖:...
3.1.3 一元強鹼滴定二元弱酸溶液/0833.2 酸鹼滴定原理/0873.2.1 一元強酸滴定的林邦滴定曲線方程/0873.2.2 一元弱酸滴定的林邦滴定曲線方程/088...
§2.2.2 強鹼滴定弱酸(強酸滴定弱鹼)2.2.3 多元弱酸(鹼)的滴定§2.2.4 混合酸的分步滴定§2.3 敏銳指數§2.4 酸鹼滴定的套用...
3.2 酸鹼滴定曲線和指示劑的選擇3.2.1 強鹼(酸)滴定強酸(鹼)3.2.2 強鹼滴定弱酸3.2.3 強酸滴定弱鹼3.3 酸鹼滴定法的套用...
3.2.1 強鹼(酸)滴定強酸(鹼) 51 3.2.2 強鹼滴定弱酸 53 3.2.3 強酸滴定弱鹼 53 3.3 酸鹼滴定法的套用 54 3.3.1 鹼度的測定 54 3.3.2 酸度及其...
3.3.1 強鹼滴定強酸(強酸滴定強鹼)3.3.2 強鹼滴定弱酸3.3.3 強酸滴定弱鹼3.3.4 多元酸的滴定3.3.5 多元鹼(多元酸鹽)的滴定3.4 酸鹼滴定法的套用...
第四節 酸鹼滴定曲線及指示劑的選擇196一、強鹼滴定強酸197二、強鹼滴定弱酸199三、多元酸、混合酸和多元鹼的滴定203第五節 酸鹼標準溶液的配製和標定206...
表2-12 水溶液酸鹼滴定的指示劑及其變色的pH範圍表2-13 酸鹼滴定中的混合指示劑表2-14 強鹼滴定弱酸的pH突躍範圍表2-15 強酸滴定弱鹼的pH突躍範圍...
一、 強酸、強鹼的滴定60二、 強鹼滴定弱酸61三、 強酸滴定弱鹼64四、 強鹼滴定多元酸64五、 水解鹽的滴定66第五節酸鹼標準滴定溶液66一、 酸標準滴定溶液66...
第四節酸鹼滴定曲線及指示劑的選擇186一、強鹼滴定強酸187二、強鹼滴定弱酸190三、多元酸、混合酸和多元鹼的滴定193第五節酸鹼標準溶液的配製和標定196...
6.4酸鹼滴定終點的指示方法83 6.4.1指示劑法83 6.4.2電位滴定法86 6.5一元酸鹼的滴定87 6.5.1強鹼滴定強酸87 6.5.2強鹼滴定弱酸89 [1] 6.5.3強酸滴定...
強鹼滴定強酸強鹼滴定弱酸強酸滴定弱鹼§4-6 多元酸、混合酸和多元鹼的滴定多元酸的滴定混合酸的滴定多元鹼的滴定思考題4-2習題4-2...
