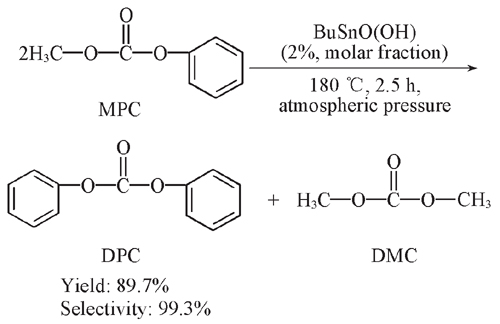
反應中,若氧化作用和還原作用發生在同一分子內部處於同一氧化態的元素上,使該元素原子(或離子)一部分被氧化,另一部分被還原,則這種自身的氧化還原反應被稱為歧化反應。
基本介紹
- 中文名:歧化反應
- 外文名:disproportionation reaction
- 套用學科:化學
- 適用領域範圍:氧化還原
- 隸屬:氧化還原反應
- 特例:康尼查羅反應
- 特性:氧化和還原作用發生同一分子內部
- 特點:某元素化合價既有上升又有下降
反應簡介
相關示例
- 化學方程式【Cl2+H2O====HClO+HCl】
- 離子方程式【Cl2+H2O====HClO+H++Cl-】(注意:次氯酸是弱酸,不能拆)
- 化學方程式【Cl2+2NaOH====NaCl+NaClO+H2O】
- 離子方程式【Cl2+2OH-====Cl-+ClO-+H2O】
- 化學方程式【3Cl2+6NaOH==△==5NaCl+NaClO3+3H2O】
- 離子方程式【3Cl2+6OH-==△==5Cl-+ClO3-+3H2O】
- 化學方程式【3NaClO==△==NaClO3+2NaCl】
- 離子方程式【3ClO-==△==ClO3-+2Cl-】
- 化學方程式【3HClO3====HClO4+2ClO2+H2O】
- 離子方程式【2C6H5CHO+OH-====C6H5COO-+C6H5CH2OH】
- 化學方程式【2Na2O2+2CO2=2Na2CO3+O2】(O2不加氣體符號)
- 【2HCHO+NaOH====CH3OH+HCOONa】
- 【2C(CH3)3-CHO+NaOH====C(CH3)3-CH2OH+C(CH3)3-COONa】