名詞解釋
電離能意義
電離能可以衡量元素的原子失去一個電子的難易程度(可近似理解為
金屬性)。
表達式
第一電離能的符號為I1,單位是kJ/mol。
氣態原子形成+1價氣態
陽離子的過程可表示為:
M(g) — e- → M+ (g)(任何形態都一樣)
規律
1.隨著核電荷數的遞增,元素的第一電離能呈現周期性變化。
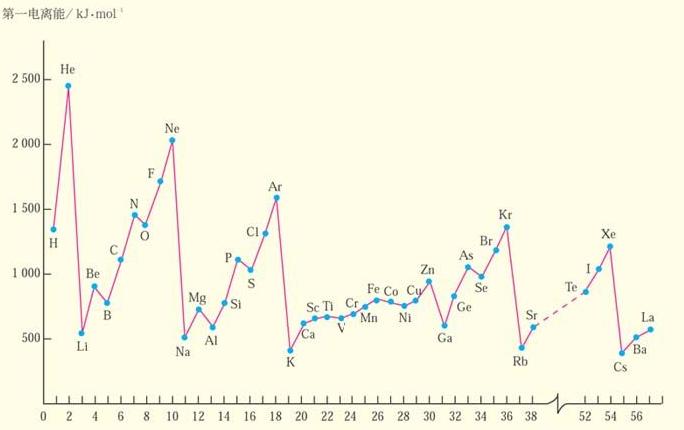 第一電離能周期性變化表
第一電離能周期性變化表2.總體上金屬元素第一電離能較小,
非金屬元素第一電離能較大。
3.同周期元素第一電離能從左到右有增大的趨勢。所以同一周期第一電離能最小的是鹼金屬元素,最大的是
稀有氣體元素。
4.同一周期內元素的第一電離能在總體增大的趨勢中有些曲折。當外圍電子在能量相等的軌道上形成全空(p0, d0, f0)、半滿(p3, d5, f7)或全滿(p6, d10, f14)結構時,原子的能量較低,元素的第一電離能較大。特例是第二主族的第一電離能大於第三主族,第五主族的第一電離能大於第六主族。
5.同一
主族元素從上到下,原子半徑增加,
有效核電荷增加不多,則原子半徑增大的影響起主要作用,第一電離能由大變小,元素的金屬性逐漸增強。
6.同一副族第一電離能變化不規則
電離能
電離能是基態的氣態原子失去電子變為氣態陽離子(即電離),必須克服核電荷對電子的引力而所需要的能量。單位為kJ·mol-1(SI單位為J· mol-1)。對於多電子原子 , 處於基態的氣態原子生成 H +氣態陽離子所需要的能量, 稱為第一電離勢 ,常用符號 I1 表示 :M (g)——— M +(g)+e。第一電離勢 =I 1(1 可省去)。電離勢應該為正值因為從原子取走電子需要消耗能量。
形成原因
在化學實踐中, 經常需要討論元素金屬性或非金屬性強弱的問題。我們衡量的標準是:對金屬元素而言,常依據它失電子能力的強弱,失電子能力強者則金屬性強, 反之則弱。顯然, 這只是定性的判斷, 那么, 在化學中定量的判斷是什麼呢? 由此,隨之產生了元素的電離能、電子親合能、電負性和電極電勢四個概念。本文將討論四者的聯繫與區別及作為定量判斷標準的依據。
原子性質
根據電離能和電子親合能的概念, 先討論元素游離態的原子的性質。化學工作者發現氣態氫原子的1S 電子,若得到13.6ev 的能量, 將從基態躍遷到n=∞的高能級, 成為自由電子;氫原子失去一個電子變為正一價的氣態陽離子, 我們說氫的電離能(I1)為13.6ev 。又如典型鹼金屬Na 的電離能為5 .139ev(I1),表示只需5 .139ev 的能量,Na原子將失去最外層的一個電子,變成金屬陽離子。而5.139ev <13.6ev,可見Na 金屬性很強。相應的非金屬元素, 如氟的第1電離能為17.422ev ,比氫I1還要大,且遠比Na 的I1大,足以說明氟不可能顯金屬性,那么它的非金屬性有多強呢? 查表知氟的電子親合能為327.9kJ .mol ,表示氟原子加合一個電子時,要放出327.9kJ.mol的能量, 即它得電子的能力很強,是典型的非金屬性元素。上面只是考察元素游離態原子的非金屬性與金屬性,但在化學實踐中,更多的要討論在分子環境中原子吸引電子能力的強弱, 這時就要用到電負性的概念。這個統一的標準可以把金屬元素與非金屬元素放到一起, 綜合考察它們的性質及在元素周期表中的遞變規律。前面提到的Na ,它的電負性為0 .9,而F 的電負性為4 .0,是所有元素中最大的,當然也是非金屬性最強的元素。又據鮑林標度大體規律, 金屬元素的電負性在~2.0以下,非金屬元素的電負性在~2.0以上。這樣判斷元素的這兩種性質有了統一尺度, 而且兩種不同元素間也有分界。
由此可見, 元素的金屬性和非金屬性與上述三者性質緊密結合在一起了。元素的電離能、電子親合能、電負性作為判斷元素金屬性與非金屬性的定量尺度發揮著重要作用。然而,上面是討論的氣態環境中元素的有關性質。那么,在水溶液中性質也相似嗎?化學理論產生於化學實踐。為了度量元素在水溶液中金屬性與非金屬性強弱, 我們又引入了元素電極電勢的概念。對於金屬元素, 如銅半電池的標準電極電勢為+0.3419 V ,鋅半池的標準電極勢為-0 .7618V ,顯然0.3419>(-0.7618 V),即鋅比銅金屬性強。鋅的電極電勢比銅的電極電勢小得多,金屬鋅是較強的還原劑,而鋅離子能在溶液中較穩定地存在, 是弱氧化劑。相反, Cu 是比Zn較強的氧化劑,而金屬銅是比金屬鋅更弱的還原劑。這樣,在水溶液中討論元素金屬性或非金屬性強弱就必須用到元素的電極電勢這個概念。
所以說,上述提到的四個概念在是兩種環境下(氣態環境和在水溶液中)考察元素金屬性與非金屬性強弱的重要的定量標準。
重要概念
1 元素的電離能
對於多電子原子, 處於基態的氣態原子生成H 氣態陽離子所需要的能量,稱為第一電離勢,常用符號I1表示:
M (g)———M (g)+e第一電離勢=I1(1可省去)。電離勢應該為正值因為從原子取走電子需要消耗能量。元素的原子電離勢越小,表示氣態時越容易失去電子,即該元素在氣態時的金屬性越強。電離勢的數值大小主要取決於原子的有效核電荷,原子半徑以及原子的電子構型。一般來說, 同一周期的元素具有相同的電子層數,從左至右有效核電荷增大,原子的半徑減小,核對外層電子的引力加大。因此,越靠右的元素, 越不易失去電子, 電離勢也就越大,同一族元素電子層數不同,最外層電子數相同原子半徑增大起主要作用。因此, 半徑越大, 核對電子引力越小, 越易失去電子, 電離勢也就越小。電子構型是影響電離勢的第三個因素, 各周期中希有氣體元素的電離勢最大,部分原因是由於希有氣體元素的電子具有相對穩定的8 電子最外層構型。某些元素具有全充滿和半充滿的電子構型,穩定性也較高。如Zn (3d 4S ),Cd(4d 5S ),Hg(5d 6 S)比同周期相鄰元素的電離勢高。
2 電子親合勢
當元素處於基態的氣態原子獲得一個電子成為負一價氣態陰離子時所放出的能量, 稱為該元素的第1 電子親合勢。電子親合勢越大, 該元素越容易獲得電子。金屬元素的電子親合勢都比較小, 說明金屬在通常情況下難於獲得電子形成負價陰離子。
早期的元素的電子親合勢數據不夠完整。94 年李國勝撰文提出電子親合勢A =az′/(r)nl+b(r )nl+Co.
該式表示, A同時與兩個常量z′/(r)nl及(r)nl相關, 而對同一元素, Z′/(r)nl與(r)nl間又有一定的制約關係。
其中, a, b, c表示常數, r為軌道半徑,n、l 為軌道的主量子數和角量子數。又Z′/(r)nl代表價電子平均核勢,(r)nl與核吸引能成反比, 在某種程度上則可反映電子間的排斥作用, 作為得電子能力標誌的電子親合能與這兩種因素相關, 從物理概念上是不難理解的。
A的周期性變化實際上代表了Z′/(r)nl與(r)nl周期性變化, 同元素的原子半徑, 電離能、電負性一樣, 這種根本原因在於元素電子層結構的周期性變化。而Z′/(r)nl及(r)nl似乎更與這種微觀電子結構聯繫起來。
3 元素的電負性
物質發生化學反應時, 是原子的外層電子在發生變化。原子對電子吸引能力不同, 是造成元素化學性質有差別的本質原因, 元素的電負性的概念, 就是用來表示元素相互化合時,原子在分子中吸引成鍵電子對的相對能力。因此鮑林定義電負性為“電負性是元素的原子在分子中吸引電子的能力”指定H的電負性為2 .1,求出了其它元素的相對電負性。
在周期表中每一周期元素從左到右電負性都是隨著原子序數增加而逐漸變大;對於每一族的某些主族元素, 從下到上隨著原子半徑的減小而增大。這樣一來,除了稀有氣體,電負性最高的元素是周期表中右上方的氟(4.0), 電負性最低的元素是周期表中左下方的銫和鍅(0.7), 一般來說,金屬元素的電負性在2 .0以下,非金屬元素的電負性在2 .0 以上。
4 元素的電極電勢
對於金屬元素而言,其電極電勢是處於基態的原子與水溶液中的水合離子的電勢差。它的大小取決於金屬原子離子化的傾向及其它因素。由金屬晶體到水合離子有三個過程:一、金屬由固態轉變為氣態原子, 其升華熱為S ;二、金屬氣態原子失去電子,變成氣態離子, 電離能為IA;三、金屬氣態離子M氣變為水合離子M水合,水合熱為Q水合。
假想金屬進入溶液中的狀態直接為氣態原子,不考慮其狀態變化。這樣,在水溶液中只存在金屬氣態原子和水合離子。已知金屬晶體裡有金屬陽離子和公共化電子, 當把金屬放到含有該金屬離子的鹽溶液時, 有兩種反應傾向存在:一方面,金屬表面的離子進入溶液和水分子結合成為水合離子;另一方面,溶液中的水合離子有從金屬表面獲得電子,沉澱到金屬上的傾向。這裡,也存在一個電子轉移的過程和在以水為介質,金屬原子與離子相互作用的過程。
因此,常用元素的電極電勢高低來比較金屬性或非金屬性強弱。如上文提到的銅半電池的標準電極電勢為+0.3419V,鋅半電池的標準電極電勢為-0.7618V。顯然, 鋅半電池的電極電勢小於銅的, 因此說在溶液中鋅比銅金屬性強, 鋅易失電子, 被氧化, 成為金屬陽離子。在元素周期表中,電極電勢雖然規律性不那么明顯, 但也能反映元素金屬性和非金屬性的遞變。
區別聯繫
四者雖然都是元素金屬性和非金屬性的量度, 但它們之間是有區別的。前三者是衡量原子得失電子能力大小的難易程度,即孤立原子電子結構穩定性大小的標誌,而後者(電極電勢)則是物質在水溶液中得失電子、形成水合離子趨勢的量度。根據波恩—哈伯循環,有反應:M(aq)+e →M (s)。電離能只是電極反應過程中能量的一部分。一般說來電離能大,電子親合能也大,但電極電勢是否越正,還要看水合能大小。在周期表中, 隨著原子結構的周期性變化,四者呈現周期化變化,電極電勢雖然受影響因素較多,規律性不那么明顯,但四者所判斷的元素的金屬性和非金屬性變化規律基本一致。那么周期系中金屬性和非金屬性一般規律如何呢? 其中, 稀有氣體元素的原子最外層電子是全充滿的有最穩定的結構,因此無論失去或獲得電子都很困難 ,電離能最大,電子親合能為 0 , 電極電勢難以測定。再看其它元素,同一周期從左至右 :四者的數值是逐漸增大, 金屬性變弱 ;同一主族從上至下 ;四者的數值是逐漸變小, 金屬性變強。而非金屬性變化規律反之。
實際套用
第一電離能
元素的第一電離能具有周期性。就是說它在周期表中的變化具有一定的重複性。舉例來說,從 Li 到 Ne 的第一電離能變化和從Na 到 Ar 的第一電離能變化之間存在著相似性。
通過套用原子的
電子排布知識,我們可以對第一電離能的所有變化進行解釋。
電離能是某特定電子擺脫
原子核引力所需的能量。電離能高表明原子核和電子間的吸引力強。
原子核的
質子越多,其所帶的電荷就越多,對電子的吸引就越強。
隨著距離加大,吸引力會迅速減小。比起離原子核稍遠的電子,緊靠原子核的電子所受到的吸引要強烈的多。
舉例來說,鈉
原子的電子排列是2,8,1。(在這裡用這個標記法更方便一些!)
鈉的外層
能級電子往原子核的方向看, 並不能看清原子核。因為在它和原子核之間存在第一和第二能級的電子。內層能級的10個電子對外層能級的電子有排斥作用,這種排斥作用與原子核11個
質子對外層電子的吸引作用共存。兩相抵消後,外層電子能感覺到來自原子核的約 1+ 左右的淨吸引力。內層電子的這種抵消被稱為內層
電子對外層電子的
禁止(screening) 。
警告! 電子當然不可能 "看見" 東西! 只是為了有助於大家理解,我才這樣說。在考試中千萬不要像我這樣說! 這種不嚴謹用詞會讓閱卷人感到為難。
被電離的電子
同一p軌域中的兩個電子間存在一定的排斥作用,這種排斥作用有利於電子脫離原子;所以同一p軌域中的配對電子比單個電子更容易被電離。
氫(H)的
電子排布為 1s1。
氫原子很小,氫原子唯一的一個電子緊靠
原子核,並被原子核強烈地吸引著。而且電子和原子核之間沒有禁止,所以氫原子的電離能比較高 (1310 kJ mol-1) 。
氦(He)的電子排布為 1s2。氦的電子所在的軌域與氫原子相同。電子離原子核近且沒有禁止。氦的電離能 (2370 kJ mol-1) 比氫高得多,這是由於
氦原子有2個
質子吸引電子,而氫原子只有一個。
鋰(Li) 1s
2 2s
1 。的外層電子位於第二能級,離原子核更遠。如果有人辯解鋰
原子核多出的一個質子會抵消距離所帶來的吸引力減小, 那么他一定是忘了 1s2 電子的禁止作用:外層電子實際上不能充分感受到來自原子核的吸引。
 第一電離能周期性變化表
第一電離能周期性變化表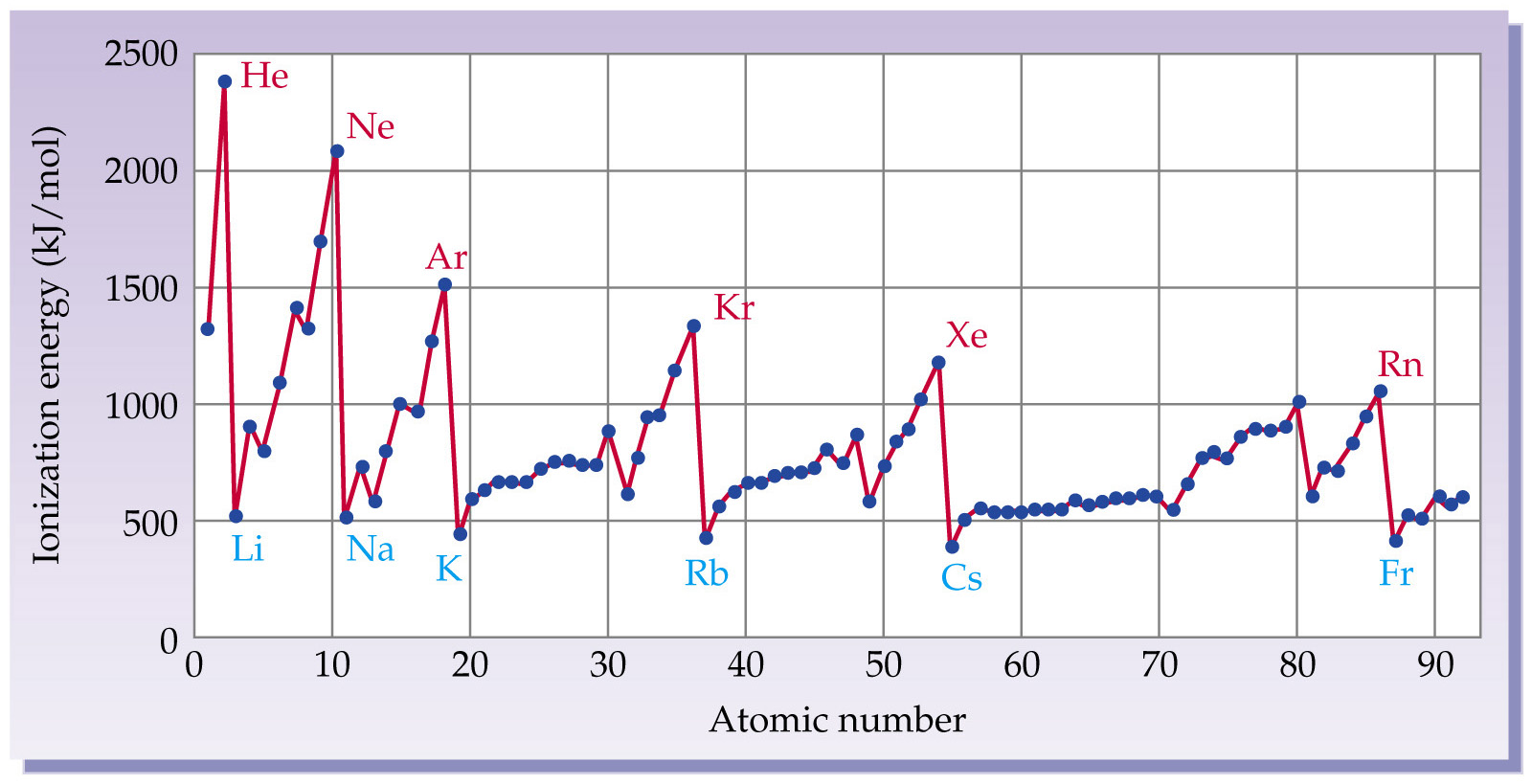
 第一電離能周期性變化表
第一電離能周期性變化表