原理
核酸探針技術原理是
鹼基配對。互補的兩條核酸單鏈通過退火形成
雙鏈,這一過程稱為
核酸雜交。核酸探針是指帶有
標記物的已知序列的核酸片段,它能和與其互補的核酸序列雜交,形成雙鏈,所以可用於待測核酸樣品中特定
基因序列的檢測。每一種病原體都具有獨特的核酸片段,通過分離和標記這些片段就可製備出探針,用於疾病的診斷等研究。
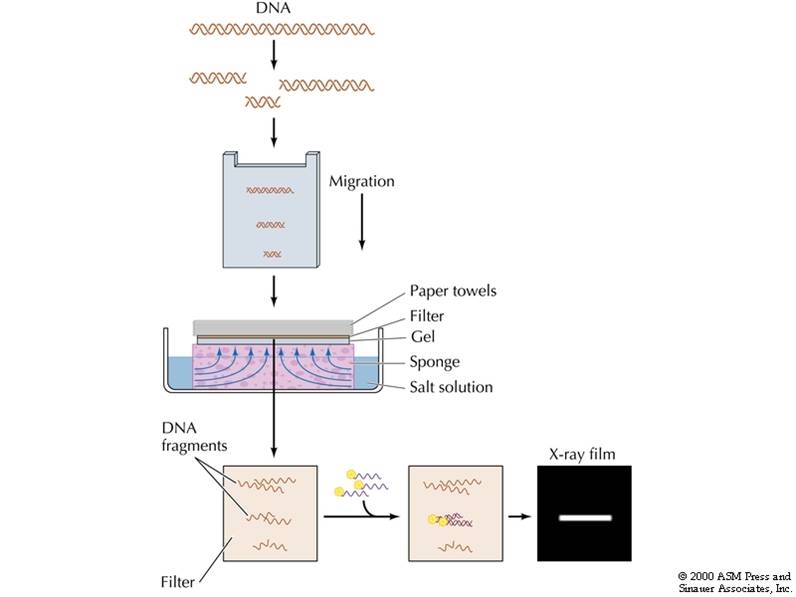 核酸探針流程
核酸探針流程 種類
按性質劃分
作為
診斷試劑,較常使用的是基因組DNA探針和cDNA探針。其中,前者套用最為廣泛,它的製備可通過
酶切或
聚合酶鏈反應(PCR)從基因組中獲得特異的DNA後將其克隆到質粒或
噬菌體載體中,隨著質粒的複製或
噬菌體的增殖而獲得大量高純度的DNA探針。將 RNA進行
反轉錄,所獲得的產物即為
cDNA。cDNA探針適用於
RNA病毒的檢測。cDNA探針序列也可克隆到
質粒或噬菌體中,以便大量製備。
將信息RNA(mRNA)標記也可作為
核酸分子雜交的探針。但由於來源極不方便,且RNA極易被環境中大量存在的
核酸酶所降解,操作不便,因此套用較少。
用人工合成的
寡聚核苷酸片段做為
核酸雜交探針套用十分廣泛,可根據需要隨心所欲合成相應的序列,可合成僅有幾十個bp的探針序列,對於檢測
點突變和小段鹼基的缺失或插入尤為適用
按標記物劃分
有
放射性標記探針和非放射性標記探針兩大類。放射性標記探針用
放射性同位素做為標記物。放射性同位素是最早使用,也是目前套用最廣泛的探針標記物。常用的同位素有32P、3H、35S。其中,以32P套用最普遍。放射性標記的優點是靈敏度高,可以檢測到Pg級;缺點是易造成
放射性污染,同位素
半衰期短、不穩定、成本高等。因此,放射性標記的探針不能實現商品化。目前,許多實驗室都致力於發展
非放射性標記的探針。
目前套用較多的非放射性標記物是生物素(Biotin)和
地高辛(digoxigenin)。二者都是
半抗原。生物素是一種小分子水溶性維生素,對
親和素有獨特的親和力,兩者能形成穩定的複合物,通過連線在親和素或
抗生物素蛋白上的顯色物質(如酶、
螢光素等)進行檢測。地高辛是一種
類固醇半抗原分子,可利用其抗體進行免疫檢測,原理類似於生物素的檢測。地高辛標記核酸探針的檢測靈敏度可與
放射性同位素標記的相當,而
特異性優於生物素標記,其套用日趨廣泛。
標記
放射性標記法
切口平移法(nick translation)是利用大腸桿菌
DNA聚合酶I (E.coli DNA polymerase I) 的多種酶促活性將標記的dNTP摻入到新形成的DNA鏈中去,形成均勻標記的高比活
DNA探針。其操作方法如下:
⑴取1?g DNA溶於少量無菌雙蒸水中,加入5?l距離大約10×
切口平移緩衝液 (0.5mol/L Tris-HCl,PH7.2;0.1 mol/L MgSO4 ;1mmol/L
二硫蘇糖醇;500?g/mL
牛血清白蛋白),加入除標記物(如?-32 p-dATP)外的其它三種
dNTP(如dCTP,
dGTP,
dTTP)溶液,20mmol/L溶液各1?l。
⑵加入100?ci(10?l)標記物溶液,加入無菌雙蒸水至終體積為46.5?l,混勻,加入0.5?l稀釋的DNaseI溶液,混勻;加入1?l(約5單位)E.coli DNA polymerase I,混勻。
⑶置14-16℃反應1-2小時。
非放射性標記法
可將生物素、
地高辛連線在
dNTP上,然後象
放射性標記一樣用酶促聚合法摻入到核酸鏈中製備標記探針。也可讓生物素、地高辛等直接與核酸進行化學反應而連線上核酸鏈。其中,生物素的光化學標記法較為常用。其原理是利用能被
可見光激活的生物素衍生物-光敏生物素(photobiotin),光敏生物素與核酸探針混合後,在強的可見光照射下,可與核酸共價相連,形成
生物素標記的核酸探針。可適用於單、雙鏈DNA及RNA的標記,探針可在-20℃下保存8-10個月以上。具體操作方法如下:
⑴將雙鏈DNA變性或用NaOH處理形成缺口,
單鏈DNA或RNA毋需處理,將核酸樣品溶於水。
⑵暗室下在
微量離心管中加入10?g DNA,1mg/ml光敏生物素20?l,加水至50?l,混勻。
⑶冰浴中打開
離心管蓋,在300-500瓦燈下照射10分鐘(液面距燈泡10cm)。
⑷加入100?l 0.1mol/L Tris-HCl,pH8.0,加入100?l
2-丁醇抽提兩次,離心,棄上層。
⑸乙醇沉澱核酸探針;用70%乙醇漂洗真空抽乾,備用。
除上述標記法外,探針的製備和標記還可通過PCR反應直接完成。
核酸雜交
雜交技術有
固相雜交和
液相雜交之分。固相雜交技術較為常用,先將待測核酸結合到一定的固相支持物上,再與液相中的標記探針進行雜交。固相支持物常用
硝酸纖維素膜(nitrocellulose filter membrane,簡稱NC膜)或尼龍膜(nylon membrane)。
固相雜交包括膜上
印跡雜交和
原位雜交。前者包括三個基本過程:第一,通過
印跡技術將核酸片段轉移到固相支持物上;第二,用標記探針與支持物上的核酸片段進行雜交;第三,雜交信號的檢測。
用探針對細胞或組織切片中的
核酸雜交並進行檢測的方法稱之為核酸原位雜交。某特點是靶分子固定在細胞中,細胞固定在
載玻片上,以固定的細胞代替純化的核酸,然後將載玻片浸入溶有探針的溶液里,探針進入組織細胞與靶
分子雜交,而靶分子仍固定在細胞內。例如。可用
特異性的細菌、病毒的核酸做為探針對組織、細胞進行原位雜交,以確定有無該病原體的感染等。原位雜交不需從組織中提取核酸,對於組織中含量極低的靶序列有極高的敏感性,在臨床套用上有獨特的意義。
近年來
液相雜交技術有所發展。液相雜交與
固相雜交的主要區別是不用純化或固定的靶分子,探針與靶序列直接在溶液里作用。液相雜交步驟有所簡化,雜交速度有所提高,增加了特異性和敏感性,但與臨床診斷所要求的特異性和敏感性還有一定的距離。
印跡技術
斑點印跡
(Dot-blot) 將待測核酸樣品變性後直接點樣在膜上,稱之為斑點印跡。為使核酸牢固結合在膜上,通常還將點樣後的膜進行80℃真空烘烤2h。
套用斑點印跡技術,可在一張膜上同時進行多個樣品的檢測,操作簡便、快速,在臨床診斷中套用較廣。適合進行特定
基因的定性及
定量研究,但不能鑑定所測基因的分子量。
Southern印跡
(Southern blot) 這是指將DNA片段經
瓊脂糖凝膠電泳分離後轉移到固相支持物上的過程。
Southern印跡的操作方法有三種:
毛細管轉移
(或
虹吸印跡)。這是一傳統方法,進行
毛細管轉移時,DNA片段由液流攜帶從凝膠轉移到固相支持物表面。安放裝置時,在轉移槽中央的平台上由下到上依次疊放變性凝膠、
濾膜、一疊乾的吸水紙巾;凝膠與轉移
緩衝液通過一紙橋連線;濾膜上的紙巾吸水而產生並維持
毛細管作用,液體由於毛細管作用抽吸通過凝膠,並將DNA片段攜帶聚集在濾膜上。DNA片段的大小和
瓊脂的濃度決定了轉移的速度。小片段DNA(<1kb)在1小時內可從 0.7%
瓊脂糖凝膠上幾乎定量轉移,而大片段DNA的轉移較慢且效率較低,如大於15kb的 DNA片段需要18小時而轉移尚不完全。
電轉移
利用電場的電泳作用將凝膠中的
DNA轉移到固相支持物上,可達到簡單、迅速、高效的目的。一般2-3小時內可轉移完畢。電轉法不宜採用NC膜,因為NC膜結合 DNA依賴高鹽溶液,而高鹽溶液在電泳過程中會破壞緩衝體系,使
DNA損傷。一般使用化學活化膜和
正電荷修飾的尼龍膜。此外,電轉過程中轉移體系的溫度升高,必須使用循環冷卻水。商業化的電轉儀一般附有冷卻設備,也可在冷室中進行。具體操作時,按儀器使用說明安裝電轉裝置,將變性凝膠夾在
轉移膜內平行電極內側的多孔板之間,排除夾層間氣泡,加入轉移
緩衝液並通電進行電轉。
真空印跡法
這是近年來發展起來的一種簡單、快速、高效的DNA和
RNA印跡法。其基本原理是利用真空作用將轉膜緩衝液從凝膠上層的容器抽到下層,凝膠中的核酸片段將隨緩衝液移置到凝膠下面的固相支持物上。這一方法的最大優點是快速高效,可在轉膜的同時進行DNA的變性與中和,30分鐘至1小時可完成,適合檢疫工作的要求。已有商業化的
真空轉移儀提供,可按商品使用說明進行操作。
Southern印跡後的
濾膜仍需進行固定處理,對NC膜可用80℃真空烘烤2小時,對尼龍膜還可用短波紫外線(波長254nm)照射幾分鐘。
Northern印跡
Northern印跡的方法與
Southern印跡基本相同,可參照進行。但RNA的變性方法與 DNA不同。DNA樣品可先通過
凝膠電泳進行分離,再用鹼處理凝膠使
DNA變性。而RNA不能用鹼變性,因為鹼會導致RNA
水解。因此,在Northern印跡前,須進行RNA變性
電泳,在電泳過程中使RNA解離形成單鏈分布在凝膠上,再進行
印跡轉移。
RNA變性電泳的原理,是用一定劑量的
乙二醛-二甲基亞礬,或甲醛和甲基
氫氧化汞等處理RNA樣品和凝膠,使
雙鏈RNA在電泳過程中變性而完全解離形成單鏈。
雜交反應
預雜交
預雜交的目的是用非特異性
DNA分子(鮭精DNA或小牛
胸腺DNA)及其它高分子化合物(Denhart’s溶液)將待測核酸分子中的非特異性位點封閉,以避免這些位點與探針的非特異性結合。雜交反應是使單鏈核酸探針與固定在膜上的待測核酸單鏈在一定溫度和條件下進行復性反應的過程。雜交反應結束後,應進行洗膜處理以洗去非
特異性雜交以及未雜交的標記探針,以避免干擾特異性雜交信號的檢測。膜洗淨後,將繼續進行雜交信號的檢測。
⑴以
放射性標記探針與固定在NC膜上的核酸進行雜交為例,雜交反應操作如下:
① 配製所需試劑
SSC溶液(20×):3mol/L NaCl,0.3mol/L
檸檬酸鈉。
預雜交液:6×
SSC,5×Denhardt’s溶液,0.5%SDS,100?g/ml經變性或斷裂成片段的鮭精DNA。
② 將含靶核酸的NC膜漂浮於6×SSC液面,使其由下至上完全濕潤,並繼續浸泡2分鐘。
③ 將濕潤NC膜裝入塑膠袋中,按0.2ml/cm2的量加入
預雜交液,儘可能擠出氣泡,將袋封口,置68℃水浴1-2小時或過夜。
④ 將雙鏈探針做
變性處理使成單鏈,即於100℃加熱5分鐘,然後立即置冰浴使驟冷。
⑤ 從水浴中取出雜交袋,剪去一角,將單鏈探針加入,儘可能將袋內空氣擠出去,重新封口,並將雜交袋裝入另一個乾淨的袋內,封閉,以防
放射性污染。
⑥ 將雜交袋浸入68℃水浴,溫育8-16小時。
⑦ 取出雜交袋,剪開,取出
濾膜迅速浸泡於大量2×SSC和0.5%SDS中,室溫振盪5分鐘,勿使濾膜乾燥。
⑧ 將NC膜移入盛有大量2×SSC和0.1%SDS溶液的容器中,室溫漂洗15分鐘。
⑨ 將NC膜移入一盛有大量0.1×SSC和0.5%SDS溶液的容器中,37℃漂洗30分鐘至1小時。
⑩ 將NC膜移入一盛有新配0.1×SSC和0.5%SDS溶液的容器中,68℃漂洗30分鐘至1小時。
⑾取出濾膜,用0.1×SSC室溫稍稍漂洗,然後置濾紙上吸去大部分液體,待做雜交信號的檢測。
雜交信號的檢測
當探針是
放射性標記時,雜交信號的檢測通過
放射自顯影進行。即利用
放射線在X光片上的成影作用來檢測雜交信號。操作時,在暗室內將
濾膜與
增感屏、X光片依序放置暗盒中,再將暗盒置-70℃曝光適當時間,取出X光片,進行顯影和定影處理。
對於
非放射性標記的探針,則需將非放射性標記物與檢測系統
偶聯,再經檢測系統的
顯色反應來檢測雜交信號。以
地高辛的
鹼性磷酸酶檢測反應為例,地高辛(Dig)是一種
半抗原,雜交反應結束後,可加入鹼性磷酸酶標記的抗Dig抗體,使之在膜上的雜交位點形成酶標抗體Dig複合物,再加入酶底物如氮藍四唑鹽(NBT)和5-溴-4-氯-3-
吲哚酚磷酸
甲苯胺鹽(BCIP),在酶促作用下,底物開始顯藍紫色。其基本反應程式類似ELISA,雜交信號的強弱,通過底物顯色程度的深淺、有無來確定。
套用
核酸探針技術是目前分子生物學中套用最廣泛的技術之一,是定性或定量檢測特異RNA或DNA序列的有力工具。核酸探針可用以檢測任何特定病原微生物,並能鑑別密切相關的毒 (菌)株和寄生蟲。目前,各種常見病毒病的診斷和研究都已套用到
核酸探針技術,這方面的研究報導數以萬計且與日俱增。但該項技術的操作畢竟比常規方法複雜,費用較高,在動物檢疫中尚未推廣。多在實驗室內對病原作深入研究時使用。
 核酸探針流程
核酸探針流程
 核酸探針流程
核酸探針流程