基本介紹
- 中文名:化學反應速率常數
- 外文名:rate constant of reaction
- 別稱:速率係數
- 表達式: r=k【A】^a【B】^b
- 套用學科:化學
- 適用領域範圍:反應速率
定義
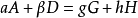
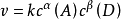

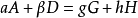
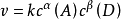

反應速率方程 r=k【A】^a【B】^b,此比例係數k,是一個與濃度無關的量,稱為速率常數(rate constant),也稱為速率係數。...
在化學動力學中,反應速率常數,又稱速率常數 k或 λ是化學反應速率的量化表示方式。...... 在化學動力學中,反應速率常數,又稱速率常數k或λ是化學反應速率的量化...
消除速率常數的概念是單位時間化合物消除量與總量的比,範疇是毒物動力學。...... 消除速率常數是單位時間內外來化合物從體內的消除量與體內總量的比值(Kc)。是毒...
定義 態-態速率常數state-to-start rate consrant指定能態 (,,)反應物變為指定能態(。’)產物的反應速率常數,寫作 k(u}二,g ),.g為相對速率,也稱精細...
克馬速率常數kerma rare cnnstan:發射光子的(Y射 線。特徵X射線和韌致輻射)放射性核素的空氣克馬速率常 數定義為I-'。二IZFCCIA,其中K}是相距一個活性為A的...
微生物工程中死亡速率常數也稱比死亡速率...... 微生物工程中死亡速率常數也稱比死亡速率 死亡速率常數 k,是微生物耐熱性的一種特徵,它隨微生物種類和滅菌溫度而異...
比反應常數也叫比反應速率常數、反應速率常數,反應速率方程 r=k【A】^a【B】^b,此比例係數k,是一個與濃度無關的量,稱為比反應常數。...
排除速率常數是指水生生物在單位時間中通過各種途徑把體內的化學物排出體外的速率。排除曲線呈負指數式,開始較快,以後逐漸減慢。...
一級速率消除是指血中藥物消除速率與血中藥物濃度成正比,血藥濃度高,單位時間內消除的藥量多,當血藥濃度降低後,藥物消除速率也按比例下降,也稱為定比消除。...
亦稱“耗氧速率常數”。河段中的有機物在生化降解過程中利用水體中的溶解氧的速度。常用符號K1或k1表示,量綱為[T-1]。其值因污水性質不同而異。一般應通過...
化學反應速率方程是利用反應物濃度或分壓計算化學反應的反應速率的方程。而化學反應速率通常指的是單位時間內反應物濃度的減少或生成物濃度的增加。根據時間的長短,...
遷移速率常數是指在穩定態時,某一元素或化學物質在某地球化學庫中停留時間的倒數。可用某一元素或組分由地球化學庫中輸出(或向該庫輸入)通量與它在庫中的存在...
米氏常數(Km)的含義是酶促反應達最大速度(Vm)一半時的底物(S)的濃度。它是酶的一個特徵性物理量,其大小與酶的性質有關。它被廣泛套用到生物化學、分子生物學...
終止反應速率常數是聚合反應過程中鏈終止階段的反應速率常數。...... 終止反應速率常數是聚合反應過程中鏈終止階段的反應速率常數。根據鏈終}r的方式不同又可細分為...
表示過渡反應的時間過程的常數。指該物理量從最大值衰減到最大值的1/e所需要的時間。對於某一按指數規律衰變的量,其幅值衰變為1/e倍時所需的時間稱為時間常數...
中文名稱 雙分子速率常數 英文名稱 bimolecular rate constant;K i 定義 表明抑制劑對乙醯膽鹼酯酶抑制能力的一個常數,它決定於抑制劑對酶的親和力和磷醯化或...
衰減係數又稱衰減常數。是傳播係數的實數部分。它包括兩部分:經典吸收和分子吸收。經典吸收是由於空氣的粘滯性、熱傳導效應以及空氣分子轉動等所產生的聲能耗散,其...
阿倫尼烏斯公式(Arrhenius equation )是由瑞典的阿倫尼烏斯所創立的化學反應速率常數隨溫度變化關係的經驗公式。公式寫作 k=Ae-Ea/RT (指數式)。k為速率常數,R為...
阿倫尼烏斯方程反應了化學反應速率常數K隨溫度變化的關係。在多數情況下,其定量規律可由阿倫尼烏斯公式來描述:K=Aexp(-Ea/RT) (1)式中:κ為反應的速率系(常)...
上式中,a為反應開始時反應物的濃度,c為t時刻時的反應物濃度,k即為速率常數,單位為時間單位的負一次方,如s-1,min-1或h-1,d-1等。 [1] ...
藥動學參數(PK parameter)是反映藥物在體內動態變化規律性的一些常數,定量描述了藥物在體內經時過程的動力學特點及作用變化規律。...
化學動力學(chemical kinetics),也稱反應動力學、化學反應動力學,是物理化學的一個分支,是研究化學過程進行的速率和反應機理的物理化學分支學科。它的研究對象是性質...
