來源,形態特徵,形態結構,編碼基因,病毒特點,病毒發展,首次發現,病毒命名,病毒現狀,抗體陰性,存活條件,體外生存,滅活方法,體液生存,感染方式,傳播途徑,致病機制,藏身之所,腸淋巴結,記憶T細胞,CD4細胞,檢測方法,抗體檢測,抗原檢測,核酸檢測,培養方法,主要症狀,疑似症狀,無症狀潛伏,人體損害,侵蝕細胞,無視抗體,助發癌變,奪取生命,疫苗研製,研究進度,起源探疑,劫持細胞,病毒抗體,激活潛伏,刪除病毒,治癒案例,
來源 2015年3月4日,多國科學家研究發現,愛滋病毒已知的4種病株,均來自喀麥隆的黑猩猩及大猩猩,是人類首次完全確定愛滋病毒毒株的所有源。
已知愛滋病毒毒株共有4種,分別是M、N、O、P,每種各有不同源頭,其中傳播最廣的M和N早已證實來自黑猩猩,但較罕見的O和P則是到後來才被證實O和P均是來自喀麥隆西南部的大猩猩。
全球至今只有兩宗P型病例,O型亦只有10萬人,主要集中在中西非。
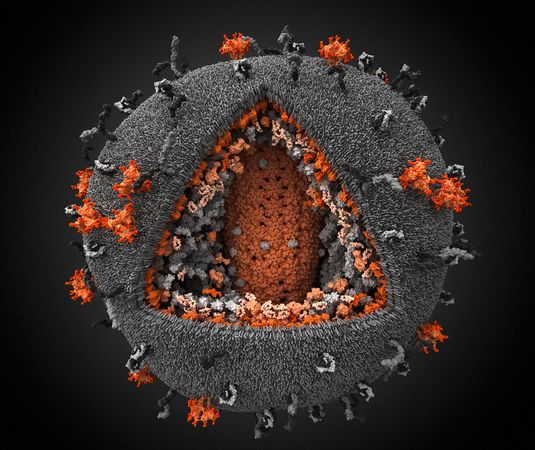
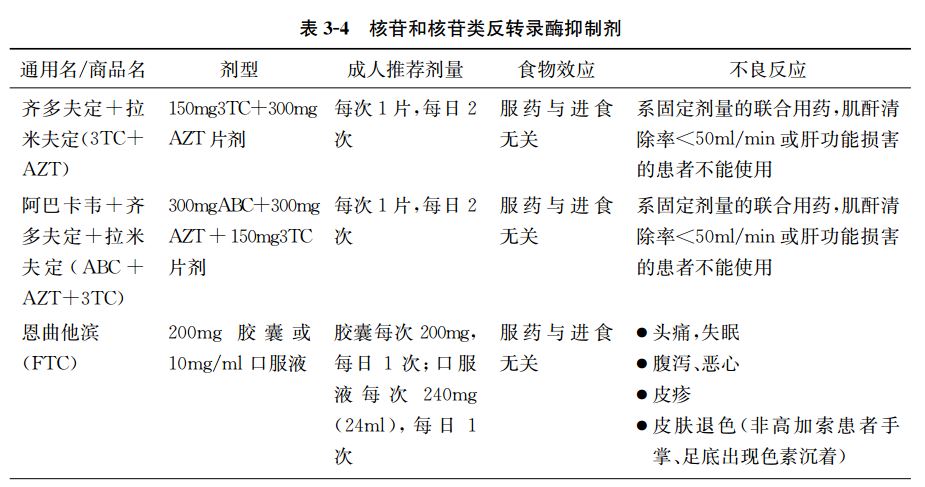
形態特徵 形態結構 人類免疫缺陷病毒直徑約120納米,大致呈球形。病毒外膜是類脂
包膜 ,來自宿主細胞,並嵌有病毒的蛋白gp120與gp41;gp41是跨膜蛋白,gp120位於表面,並與gp41通過非共價作用結合。向內是由蛋白p17形成的球形基質(Matrix),以及蛋白p24形成的半錐形
衣殼 (Capsid),衣殼在電鏡下呈高電子密度。衣殼內含有病毒的RNA基因組、酶(
逆轉錄酶 、整合酶、
蛋白酶 )以及其他來自宿主細胞的成分(如tRNAlys3,作為逆轉錄的引物)。
編碼基因 病毒基因組 是兩條相同的正鏈RNA,每條RNA長約9.2-9.8kb。兩端是
長末端重複序列 (long terminal repeats, LTR),含順式調控序列,控制
前病毒 的表達。已證明在LTR有啟動子和增強子並含負調控區。LTR之間的序列編碼了至少9個蛋白,可分為三類:結構蛋白、調控蛋白、
輔助蛋白 。
1.gag基因能編碼約500個
胺基酸 組成的聚合前體蛋白,經蛋白酶水解形成P17,P24核蛋白,使RNA不受外界核酸酶破壞。
3.env基因編碼約863個胺基酸的前體蛋白並糖基化成gp160,gp120和gp41。gp120含有中和
抗原決定簇 ,已證明HIV中和
抗原表位 ,在gp120 V3環上,V3環區是囊膜蛋白的重要功能區,在病毒與細胞融合中起重要作用。gp120與跨膜蛋白gp41以非共價鍵相連。gp41與靶細胞融合,促使病毒進入細胞內。實驗表明gp41亦有較強
抗原性 ,能誘導產生抗體反應。
4.TaT 基因編碼蛋白可與LTR結合,以增加病毒所有
基因轉錄 率,也能在轉錄後促進病毒mRNA的翻譯。
5.Rev
基因產物 是一種順式激活因子,能對env和gag中順式作用抑制序列(Cis-Acting repression sequance,Crs) 去抑制作用,增強gag和env基因的表達,以合成相應的
病毒結構 蛋白。
6.Nef基因編碼蛋白P27對HIV基因的表達有負調控作用,以推遲病毒複製。該蛋白作用於HIv cDNA的LTR,抑制整合的病毒轉錄。可能是HIV在體內維持持續感集體所必需。
7.Vif基因對HIV並非必不可少,但可能影響游離HIV感染性、
病毒體 的產生和體內傳播。
8.VPU基因為HIV-1所特有,對HIV的有效複製及病毒體的裝配與成熟不可少。
9.Vpr基因編碼蛋白是一種弱的轉錄激活物,在體內繁殖周期中起一定作用。
HIV-2基因結構與HIV-1有差別:它不含
VPU 基因,但有一功能不明VPX基因。
核酸雜交 法檢查HIV-1與HIV-2的
核苷酸序列 ,僅40%相同。env基因表達產物激發機體產生的抗體無交叉反應。
病毒特點 主要攻擊人體的輔助
T淋巴細胞 系統,一旦侵入機體細胞,病毒將會和細胞整合在一起終生難以消除;
人類免疫缺陷病毒 對外界環境的抵抗力較弱,對B肝病毒有效的消毒方法對愛滋病病毒消毒也有效;
感染者潛伏期長、死亡率高;
愛滋病病毒的基因組比已知任何一種病毒基因都複雜。
病毒發展 首次發現 愛滋病最早是於20世紀80年代初期在美國被識別,並受到當時
里根 保守政府的忽視。但在美國疾病控制與預防中心以及有識的醫生與科學家的持續工作下,累積了信服性的流行病學數據,顯示愛滋病有一定的傳染性致因(etiology),同時,因藥癮者共用針具以及輸血而感染的病例逐漸增多,許多科學家開始調查此傳染性病原。
病毒命名 在巴黎
巴斯德研究所 專門研究逆轉錄病毒與癌症關係的法國病毒學家
呂克·蒙塔尼 (Luc Montagnier)及其研究組於1983年首次從一位罹患晚期
卡波西氏肉瘤 的年輕戀愛滋病人的血液及淋巴結樣品中,分離到一種的新的逆轉錄病毒;他們發現這種病毒不同於人類T4淋巴細胞白血病病毒(Human T cell Leukemia Virus, HTLV),而是一種慢病毒(Lentivirus),他們將之命名為“免疫缺陷相關病毒”(Immune Deficiency-Associated Virus, IDAV)。
大西洋另一邊,蒙塔尼埃當時的合作者,美國國家癌症研究所的美國生物醫學科學家羅伯特·加羅(Robert Gallo)及屬下也從一些細胞株系中分離到新病毒,並將之命名為“IIIB/H9型人類T4淋巴細胞白血病病毒”(Human T cell Leukemia Virus-IIIB/H9, HTLV-IIIB/H9);加羅小組首次於1984年在《科學》期刊發表論文,論證了這種新病毒與愛滋病的病原關係。
1986年,該病毒的名稱被統一為“人類免疫缺陷病毒”(Human Immunodeficiency Virus, HIV),以更好地反映病毒導致免疫缺陷而不是導致癌症的性質。
病毒現狀 在世界範圍內導致了近1200萬人的死亡,超過3000萬人受到感染。
1986年7月25日,
世界衛生組織 (WHO)發布公報,國際病毒分類委員會會議決定,將
愛滋病 病毒改稱為人類免疫缺陷病毒(Human Immunodeficiency Virus),簡稱HIV。
在2004年,全球估計有3590至4430萬人與人類免疫缺陷病毒相伴生存,其中430至640萬人屬於新發感染病例,另外,有280至350萬人死於愛滋病。這些數字並在不斷增長中,其中,東亞、東歐、中亞等地區漲幅最快。感染最嚴重的地區仍然是
撒哈拉以南非洲 ,其次是南亞與東南亞。
抗體陰性 北京協和醫院呼吸內科、感染內科、病理科專家聯合在2017年11月的《臨床呼吸雜誌》上發表關於世界首例HIV抗體陰性愛滋病合併肺卡波西肉瘤的論文。本例肺卡波西肉瘤的影像學及病理學特徵都很典型,北京協和醫院在國內首先通過病理確診肺卡波西肉瘤,具有開創性意義,有助於提高國內醫生對該病的認識。
存活條件 體外生存 在體外生存能力極差,不耐高溫,抵抗力較低,離開人體不易生存。常溫下,在體外的血液中只可存活數小時。對熱敏感,在56℃條件下30分鐘即失去活性,故日常生活接觸中不會感染。
滅活方法 不加穩定劑時,病毒在-70℃冰凍下失去活性;而添加35%
山梨醇 或50%
胎牛血清 ,在-70℃時冰凍3個月仍保持活性。
對
消毒劑 和去污劑亦敏感,0.2%次氯酸鈉、0.1%漂白粉、70%乙醇、35%
異丙醇 、50%乙醚、0.3%H2O2 0.5%來蘇爾處理5分鐘能滅活病毒,1%NP-40和0.5%triton-X-100能滅活病毒而保留抗原性。
國際衛生組織 推薦對愛滋病病毒滅活加熱100℃持續20分鐘,效果較理想。愛滋病病毒的消毒主要是針對被
愛滋病病毒感染者 和愛滋病病人的血液、體液污染的醫療用品、生活場所等。例如,輔料、紗布、衣物等。對愛滋病病毒的消毒可以根據消毒物品選擇適當的物理方法或化學方法。需要重複使用的物品可用煮沸或高壓蒸汽消毒。不宜煮沸的物品可用2%戊二醛、
75%酒精 等進行消毒。
體液生存 室溫下,在實驗室嚴格控制的
組織培養 液的環境中的HIV可以存活15天。
一些研究機構證明 ,離體血液中HIV的存活時間決定於離體血液中病毒的含量,病毒含量高的血液,在未乾的情況下,即使在室溫中放置96小時,仍然具有活力。即使是針尖大小一滴血,如果遇到新鮮的淋巴細胞,愛滋病毒仍可在其中不斷複製,仍可以傳播。
病毒含量低的血液,經過自然乾涸2小時後,活力才喪失;而病毒含量高的血液,即使乾涸2-4小時,一旦放入培養液中,遇到淋巴細胞,仍然可以進入其中,繼續複製。但這些情況僅僅限於實驗室環境下。
據美國
cdc 報告,即使是實驗室環境,實驗室中用於實驗的比人體血液和體液濃度高得多的病毒,在乾燥幾小時後,活性下降百分之九十九。因此,除實驗室環境外,含有HIV的離體血液造成感染幾率幾乎為零。HIV不能在空氣中、水中和食物中存活,在外界這些病毒會很快死亡,即使在含有HIV的血液和其它體液中。
不在實驗室環境或者不在密閉環境(比如針筒、針頭)中,HIV是無法保持活性的。必須指出,在用過的注射針頭的殘留血液里,HIV可以存活比較長的時間,使用針頭可以直接進入人體的血液,因此,使用過的注射針頭很具有HIV傳染的危險性,用過的注射針頭絕對不可重複使用。美國相關科學研究部門經過近百萬次除外明確傳播途徑的特殊情況接觸暴露實驗所得的結果:被感染案例不到萬分之一。
感染方式 傳播途徑 HIV感染者是
傳染源 ,曾從血液、
精液 、陰道分泌液、
乳汁 等分離得HIV。握手,擁抱,接吻,游泳,蚊蟲叮咬,共用餐具,咳嗽或打噴嚏,日常接觸等不會傳播。以下介紹主要三種傳播方式:
性接觸傳播
HIV存在於感染者精液和陰道分泌物中,性行為很容易造成細微的
皮膚黏膜破損 ,病毒即可通過破損處進入血液而感染。無論是同性還是異性之間的性接觸都會導致愛滋病的傳播。愛滋病感染者的精液或陰道分泌物中有大量的病毒,在性活動(包括陰道性交、肛交和
口交 )時,由於性交部位的摩擦,很容易造成生殖器黏膜的細微破損,這時,病毒就會趁虛而入,進入未感染者的血液中。值得一提的是,由於直腸的腸壁較陰道壁更容易破損,所以肛門性交的危險性比陰道性交的危險性更大。
血液傳播
人體被輸入含有HIV的血液或血液製品、靜脈吸毒、移植感染者或病人的組織器官都有感染愛滋病的危險性。
母嬰傳播
感染了HIV的婦女在妊娠及分娩過程中,也可將病毒傳給胎兒,感染的產婦還可通過母乳餵養將病毒傳給吃奶的孩子。
致病機制 HIV選擇性的侵犯帶有CD4分子的,主要有T4
淋巴細胞 、單核
巨噬細胞 、樹突狀細胞等。
細胞表面 CD4分子是HIV受體,通過HIV囊膜蛋白gp120與細胞膜上CD4結合後,gp120構像改變使gp41暴露,同時gp120-CD4與靶細胞表面的
趨化因子 CXCR4或CXCR5結合形成CD4-gp120-CXCR4/CXCR5三分子複合物。gp41在其中起著橋的作用,利用自身的疏水作用介導病毒囊膜與細胞膜融合。最終造成細胞被破壞。其機制尚未完全清楚,可能通過以下方式起作用:
1.由於HIV包膜蛋白插入細胞或病毒出芽釋放導致細胞膜通透性增加,產生滲透性溶解。
2.受染細胞內CD-gp120複合物與細胞器(如
高爾基 氏體等)的膜融合,使之溶解,導致感染細胞迅速死亡。
3.HIV感染時未整合的DNA積累,或對細胞蛋白的抑制,導致HIV
殺傷細胞 作用。
4.HIV感染細胞表達的gp120能與未感染細胞膜上的CD4結合,在gp41作用下融合形成多核巨細胞而溶解死亡。
5.HIV感染細胞膜病毒
抗原 與特異性抗體結合,通過激活補體或介導
ADCC效應 將細胞裂解。
6.HIV誘導自身免疫,如gp41與
T4細胞 膜上MHCⅡ類分子有一同源區,由抗gp41抗體可與這類淋巴細胞起交叉反應,導致細胞破壞。
7.
細胞程式化死亡 (programmed cell death ):在
愛滋病 發病時可激活細胞凋亡 (Apoptosis) 。如HIV的gp120與CD4受體結合;直接激活受感染的細胞凋亡。甚至感染HIV的T細胞表達的囊膜抗原也可啟動正常T細胞,通過細胞表面CD4分子交聯間接地引起凋亡CD+4細胞的大量破壞,結果造成以T4細胞缺損為中心的嚴重
免疫缺陷 ,患者主要表現:外周
淋巴細胞 減少,T4/T8比例配置,對
植物血凝素 和某些抗原的反應消失,
遲髮型變態反應 下降,
NK細胞 、巨噬細胞活性減弱,IL2、
γ干擾素 等細胞因子合成減少。病程早期由於
B細胞 處於多克隆活化狀態,患者血清中lg水平往往增高,隨著疾病的進展,B細胞對各種抗原產生抗體的功能也直接和間接地受到影響。
愛滋病病毒進入人體後,首先遭到巨噬細胞的吞噬,但愛滋病病毒很快改變了巨噬細胞內某些部位的酸性環境,創造了適合其生存的條件,並隨即進入T-CD4淋巴細胞大量繁殖,最終使後一種免疫細胞遭到完全破壞。
HIV感染後可刺激機體生產囊膜蛋白(Gp120,Gp41)抗體和核心蛋白(P24)抗體。在HIV攜帶者、愛滋病病人血清中測出低水平的抗病毒中和抗體,其中愛滋病病人水平最低,HIV攜帶者最高,說明該抗體在體內有保護作用。但抗體不能與
單核巨噬細胞 記憶體留的病毒接觸,且HIV囊膜蛋白易發生抗原性變異,原有抗體失去作用,使中和抗體不能發揮應有的作用。在潛伏感染階段,HIV前病毒整合入
宿主細胞 基因組中,因此HIV不會被免疫系統所識別,所以單單依靠自身免疫功能無法將其清除。
藏身之所 長期以來,醫學界在臨床治療時發現,所有接受強化治療的
愛滋病 病毒攜帶者在停止治療後身體中很快又重新出現愛滋病病毒,並由此推斷在感染者的機體中不但存在愛滋病病毒的藏身之所,而且機體的免疫系統難以對其進行有效控制。
腸淋巴結 科學家經過進一步研究發現,腸淋巴結中的T-CD8淋巴細胞(細胞毒素T淋巴細胞)活力較差,其他組織中的這種被稱為殺手的淋巴細胞通常能夠消滅被感染的細胞,控制病毒,但腸淋巴結中的這種淋巴細胞缺乏這一能力,從而導致愛滋病病毒在其中藏身,並逐漸擴散到其他器官,使病情加重。
隨後,研究人員證實導致腸淋巴結中T-CD8淋巴細胞功能缺損的是TGF-β細胞因子,正是它抑制了T-CD8淋巴細胞的活性,導致其早衰。
法國科學家表示,他們的研究為徹底戰勝愛滋病提供了新思路,比如抑制TGF-β細胞因子,修復功能受損的T-CD8淋巴細胞,以及加強針對腸淋巴結的治療等。這也將是他們下一步的主攻課題。
記憶T細胞 記憶T細胞是一些愛滋病病毒的藏身天堂。當其細胞活著時,病毒也就活著;
細胞死亡 ,病毒便釋出,感染更多的健康細胞。
記憶T細胞,這是一種人體免疫細胞,儘管它是一些愛滋病病毒的藏身天堂,但也在一定程度上能限制這些病毒的活動。
CD4細胞 愛滋病毒會附著在CD4細胞上,再進入CD4細胞並感染它。當一個人被愛滋病毒感染時,病毒便在感染者體內免疫系統內製造更多的病毒細胞,把它變成製造病毒的工廠。愛滋病毒會不斷複製,CD4細胞則被破壞殆盡,免疫系統會再製造新的免疫細胞替代死亡的免疫細胞,但是新製造出的免疫細胞仍免除不了被愛滋病毒感染。即使感染愛滋病毒者感覺身體良好,沒有任何症狀,但這時可能已經有億萬個CD4 細胞被破壞了。CD4是最重要的免疫細胞,感染者一旦失去了大量CD4細胞,整個免疫系統就會遭到致命的打擊,對各種疾病的感染都失去抵抗力。
檢測方法 檢測HIV感染者體液中病毒抗原和抗體的方法,操作方便,易於普及套用,其中抗體檢測尤普通。但HIv P24抗原和病毒
基因 的測定,在HIV感染檢測中的地位和重要性也日益受到重視。
抗體檢測 抗體檢測
血清中HIV抗體是判斷HIV感染的間接指標。根據其主要的適用範圍,可將現有HIV抗體檢測方法分為篩檢試驗和確證試驗。
確證試劑
FDA批准的另一類篩檢確證試劑是-免疫螢光-試驗(IFA)。IFA比WB的成本低,而且操作也相對簡單,整個過程在1-1.5小時內即可結束。此法的主要缺點是需要昂貴的螢光檢測儀和有經驗的專業人員來觀察評判結果,而且實驗結果無法長期保存。現在FDA推薦在向WB不能確定的供血員發布最終結果時以IFA的陰性或陽性為準,但不作為血液合格的標準。
篩檢試驗
篩檢試驗主要用於對供血員進行篩查,因此要求操作簡便,成本低廉,而且靈敏、特異。2012年,世界上主要的篩檢方法仍然是ELISA,還有少數的顆粒凝集試劑和快速ELISA試劑。ELISA有很高的靈敏度和特異性,操作簡單,僅需要實驗室配備酶標儀和洗板機即可套用,特別適合於試驗室大規模篩檢使用。
顆粒凝集實驗是另一種操作簡單方便,成本低廉的檢測方法,該方法結果可通過肉眼判定,靈敏度很高,特別適合開發中國家或大量篩選供血員時使用,缺點是必須使用新鮮樣品,特異性較差。
80年代後期發展起來的斑點印跡檢測(Dot-blot assay)是一種快速ELISA(Rapid ELISA)方法,這種方法操作極為簡便,過程短暫,整個過程多數在5-10分鐘內甚至3分鐘內即可結束,但該法比ELISA和顆粒凝集試劑昂貴得多。
人類免疫缺陷病毒抗體口腔黏膜滲出液檢測試劑盒(膠體金法)就屬於側向免疫層析法(金免疫)類別,基於免疫層析技術通過手工操作、肉眼讀取結果、20分鐘即可定性得出檢測結果的快速診斷試劑,用於檢測口腔黏膜滲出液樣本中的HIV-1型和HIV-2型抗體。可用於自願諮詢檢測、不願採血、暈針患者的初篩。該方法適用於初篩檢測,凡由該試劑測定為陽性者,需進行進一步篩查確認。
【HIV陰性】 說明從人體內檢測不到HIV抗體,
陰性 符號以(-)表示。不能說沒有感染HIV, 要看是什麼時候檢測的,在視窗期內,感染者的體內還沒有產生HIV抗體,或還沒有產生足量的HIV抗體,這時HIV檢測是陰性結果,如果在視窗期之後檢測的,可以排除感染HIV的可能。
【HIV陽性】 說明從人體內檢測到了HIV抗體,陽性符號以(+)表示。
【檢測結果不定因素】
感染還處於視窗期:從HIV進入體內到檢測這段時間還不夠長,因此血清還沒有形成典型的抗體反應
愛滋病進展到終末期,抗體水平下降
其他非病毒蛋白抗體的交叉反應:
自身免疫性疾病 、某些惡性疾病、懷孕、輸血或器官移植等情況下,身體可以產生一些抗體,其反應與HIVP24核心蛋白抗體引起的反應很相似
抗原檢測 病原檢測主要指用病毒分離培養、電鏡形態觀察、病毒抗原檢測和基因測定等方法從宿主標本中直接檢測病毒或病毒基因。由於前兩種方法難度大,且需要特殊設備和專業技術人員。因此僅抗原檢測和RT-PCR(反轉錄-PCR)可用於臨床診斷。HIV-1P24抗原檢測可用於HIV-1抗體不確定或視窗期的輔助診斷;HIV-1抗體陽性母親所生嬰兒早期的輔助鑑別診斷;第四代HIV-1抗原/抗體
ELISA 試劑檢測呈陽性,但HIV-1抗體確認陰性者的輔助診斷。P24抗原檢測一般用ELISA雙抗體夾心法試劑,試劑必須經過SDA批准註冊、在有效期內,其陽性結果必須依據試劑說明書經中和試驗確認。HIV-1P24抗原檢測的敏感性為30-90%,該結果僅作為HIV感染的輔助診斷依據,不能據此確診;HIV-1 P24抗原檢測陰性只表示在本試驗中無反應,不能排除
HIV 感染,臨床中一般不作為常規診斷項目。
核酸檢測 HIV核酸檢測可用於HIV感染的輔助診斷、病程監控、指導治療方案及療效判定、預測疾病進展等。常用的HIV病毒載量檢測方法包括逆轉錄PCR實驗(RT-PCR)、核酸序列擴增實驗(NASBA)、分支DNA雜交實驗(bDNA)以及實時螢光定量PCR技術。值得注意的是,每一種HIVRNA定量系統都有其最低檢測限,即可以測出的最低拷貝數或國際單位,RNA定量檢測時未測出不等於樣品中不含有病毒RNA,因此HIV核酸定性檢測陰性,只可報告本次實驗結果陰性,但不能排除HIV感染;HIV核酸檢測陽性,可作為診斷HIV感染的輔助指標,不能單獨用於HIV感染的診斷。報告HIV核酸定量檢測結果時應按照儀器讀數報告結果,註明使用的實驗方法、樣品種類和樣品量,當測定結果小於最低檢測限時,應註明最低檢測限水平。
HIV核酸定性檢測也可用於HIV感染的輔助診斷,在分析HIV基因亞型和變異等基礎研究中套用。通常使用PCR或RT-PCR技術,使用分子生物學實驗室通用的擴增試劑,引物可來自文獻或自行設計,應儘量覆蓋所有或常見的毒株,也可使用複合引物。報告定性檢測結果時應註明反應條件和所使用的引物序列。此外,利用核酸檢測方法的高度敏感性,使用集合核酸擴增檢測技術和方法,對高度懷疑感染人群且抗體陰性的樣品進行集合核酸檢測,可及時發現視窗期感染者。該方法較單份樣品的核酸檢測具有更高的成本效益。
培養方法 常用方法為共培養法,即用正常人外周血液分離單個核細胞,加PHA刺激並培養後,加入病人單個核細胞診斷及愛滋病的研究中。
將病人自身外周或骨髓中淋巴細胞經PHA刺激48~72小時作體外培養(培養液中加IL2)1~2
周后 ,病毒增殖可釋放至細胞外,並使細胞融合成多核巨細胞,最後細胞破潰死亡。亦可用傳代淋巴細胞系如HT-H9、Molt-4細胞作分離及傳代。
HIV動物感染範圍窄,僅黑猩猩和長臂猿,一般多用黑猩猩做實驗。用感染HIV細胞或無細胞的HIV濾液感染黑猩猩,或將感染HIV黑猩猩血液輸給正常黑猩猩都感染成功,邊續8個月在血液和淋巴液中可持續分離到HIV,在3~5周后查出HIV特異性抗體,並繼續維持一定水平。但無論黑猩猩或長臂猿感染後都不發生疾病。
主要症狀 疑似症狀 【常見症狀】
持續廣泛
淋巴結腫大 ,特別是頸、腋和
腹股溝淋巴結 。淋巴結腫大直徑1厘米左右,堅硬、不痛、可移動,時間超過三個月。
3.食慾下降,2個月內體重減輕超過原體重的10%。
4.數周以來出現不明原因的
慢性腹瀉 ,呈水樣,每日10次以上。
5.氣促、乾咳數周。
6.皮膚、口腔出現平坦和隆起的粉紅、紫紅色大斑點,不痛不癢。
7.咽、喉部出現
白斑 。男性陰部出現
鱗屑 性斑,癢。女性肛門瘙癢,陰道瘙癢,
白帶 多。
當出現上面三個以上症狀又有不潔性接觸史時,應及時去醫院檢查。
HIV病毒引起的症狀並沒有特異性,在現實生活中,有許多原因能夠引起以上症狀,不能因為自己的身體有相關症狀就斷定自己攜帶有HIV病毒。只有進行科學的“HIV抗體/抗原檢測”才能夠得出正確的結論。
無症狀潛伏 愛滋病病毒侵入人體後一部分人一直無症狀,直接進入無症狀期。
愛滋病潛伏期 的長短個體差異極大,這可能與入侵愛滋病病毒的類型、強度、數量、感染途徑以及感染者自身的免疫功能、健康狀態、營養情況、年齡、生活和醫療條件、心理因素等有關。一般為6-10年,但是有大約5-15%的人在2-3年內就進展為
愛滋病 ,稱為快速進展者,另外還有5%的患者其免疫功能可以維持正常達12年以上,稱為長期不進展者。
人體損害 HIV不僅使人體的免疫系統難以抵禦其侵害,而且給特效治療藥物和預防用
疫苗 的研製帶來困難。HIV直接侵犯人體的免疫系統,破壞人體的
細胞免疫 和體液免疫。它主要存在於感染者和病人的體液(如血液、
精液 、
陰道分泌物 、乳汁等)及多種器官中,它可通過含HIV的體液交換或器官移植而傳播。
侵蝕細胞 現已證實HIV是嗜T4淋巴細胞和嗜神經細胞的病毒。HIV由皮膚破口或黏膜進入人體血液,主要攻擊和破壞的靶細胞T4淋巴細胞(T4淋巴細胞在細胞免疫系統中起著中心調節作用,它能促進B細胞產生抗體),便得T4細胞失去原有的正常免疫功能。當激活
免疫反應 的T4細胞幾乎全部被HIV消除,T4細胞抑制細胞在數量上巨增,相反病人體內
T4細胞 在數量上驟減,從而導致病人的免疫功能全部衰竭,為
條件性感染 創造了極為有利的條件。
HIV對神經細胞有親合力,能侵犯神經系統,引起腦組織的破壞,或者繼發條件性感染而致各種
中樞神經系統 的病變。
無視抗體 愛滋病病毒進入人體後,首先遭到巨噬細胞的吞噬,但愛滋病病毒很快改變了巨噬細胞內某些部位的酸性環境,創造了適合其生存的條件,並隨即進入T-CD4淋巴細胞大量繁殖,最終使後一種免疫細胞遭到完全破壞。 HIV囊膜蛋白易發生抗原性變異,原有抗體失去作用,使中和抗體不能發揮應有的作用。 在潛伏感染階段,HIV前病毒整合入宿主細胞基因組中,免疫會把HIV忽略不被免疫系統識別,自身免疫無法清除。
人體免疫系統具有壓制早期愛滋病病毒的能力。 最近的研究表明,大多數新感染患者都會發展出中和抗體。這些抗體是附著在病毒之上的水滴狀血液蛋白,如果它們僅面對一個目標,它們就能允許患者作出自我防禦。但問題是,愛滋病病毒具有變異的能力,其掩飾自身的本領足以使其逃避抗體的壓力 ,愛滋病病毒最終會瓦解免疫系統,使其耗竭。一些愛滋病病毒會使部分外層蛋白發生變異,變異後一種酶就有可能將一個糖分子附著其上,干擾抗體的攻擊。 但這種“聚糖盾牌”現象並不能在所有病例中觀察到。其他病毒則會使中和抗體直接粘連的部分外層蛋白發生變異。
HIV-1會入侵名為T淋巴細胞的免疫系統細胞,“劫持”T淋巴細胞的“分子機器”從而製造更多HIV-1,最終摧毀宿主細胞——這導致被感染的人群更易受到其它致命疾病的影響。然而,T淋巴細胞也不是易被擊中的目標。在它們的反病毒防禦系統里有一類名為APOBEC3s的蛋白質,後者具備阻止HIV-1自我複製的能力。然而,HIV-1也具備反防禦機制——一種名為病毒體感染因子(Vif)的蛋白質,它能夠導致T淋巴細胞摧毀自己的APOBEC3s。
助發癌變 HIV和其它
逆轉錄病毒 一樣,當逆轉錄酶使病毒的RNA作為模板合成DNA而成前病毒DNA整合到
宿主細胞 的DNA中時,HIV帶有的
致癌基因 可使細胞發生癌性轉化,特別是在細胞免疫遭到破壞,喪失免疫監視作用的情況下,細胞癌變更易發生。
奪取生命 愛滋病患者的存活時間長短與其被感染的亞型病毒種類有很大的關係。愛滋病患者的平均存活時間因被感染的亞型種類不同而有很大的差異,儘管這些研究對象被感染的病毒數量基本上是一樣的。A亞型病毒感染者的平均存活時間為8.8年,而D亞型病毒感染者的平均存活時間降至為6.9年,而D亞型和A亞型病毒的混合感染者的存活時間更短,平均只有5.8年。
疫苗研製 2009年9月,在泰國進行的一項由美國軍方支持的醫療試驗發現,某實驗性疫苗能將感染
愛滋病毒 的風險大大降低。人類首次獲得了具有一定
免疫效果 的
愛滋病疫苗 。
Challenges in the development of an HIV-1 vaccine
1) extensive viral class and sequence diversity
2) early establishment of latent viral reservoirs
3) immune correlates of protection unclear
4) viral evasion of humoral and cellular immune responses.
5) antibody responses typically type-specific
6) no method exists to elicit broadly reactive neutralizing antibodies
7) attenuated viruses unsafe for human use
8) lack of small-animal model
9) little pharmaceutical interest
翻譯:
在HIV-1疫苗的發展挑戰
1)廣泛的病毒類和序列多樣性
2)早期建立潛伏性病毒性水庫
3)免疫相關保護不清
4)體液免疫和細胞免疫應答的病毒逃避。
5)典型的抗體應答
6)不存在引起廣泛反應性中和抗體的方法
7)減毒的病毒對人類使用不安全
8)缺乏小動物模型
9)小醫藥利益
科學家在對中緬邊境地區一緬甸籍長途卡車司機進行HIV-1近乎全長基因組分析後發現,這例HIV-1 CRF01_AE/B/C重組病毒株比12年前報導的來自緬甸的HIV重組病毒株更為複雜。人類免疫缺陷病毒”(英文縮寫HIV),它侵入人體後會破壞人體的免疫系統,使人體發生多種難以治癒的感染和腫瘤,最終導致死亡。現已證實HIV分為兩型:HIV-1型和HIV-2型。在世界範圍內,HIV-1型病毒的感染占主導地位。
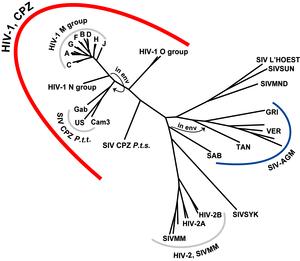
研究進度 起源探疑 隨著對愛滋病毒研究的不斷深入,人們在不同的靈長類動物身上分離到類似於HIV的猴免疫缺陷病毒,簡稱為SIV。SIV同HIV在基因大小和組成上基本相同,但是SIV在其自然宿主猴體內並不引起任何疾病。可是當把從自然宿主內分離到的SIV接種到非自然宿主猴時,將會導致類似於人類的免疫缺陷綜合症狀。例如將從佛羅里達長尾猴分離到的SIVsm接種到恆河猴時,經過一段臨床潛伏期後,則產生類似
愛滋病 的臨床症狀,如腹瀉、體重下降、CD4和CD8細胞比例失調等等。人們還發現在野生的非洲綠猴體內分離到的病毒相互間的遺傳變異非常大,並且這一變異和不同種屬猴的進化關係相一致,提示猴免疫缺陷病毒已在猴體內共同進化了相當長的時間。所有這些研究都提示人類的愛滋病毒可能是通過不同種屬間交叉傳播的形式從猴類傳播到人。
一直到了90年代初,高峰及漢(Hahn)等人在進行非洲邊遠地區HIV-2的流行研究中,為愛滋病毒的起源提供了較直接的線索,進而證明B型愛滋病毒起源於猴愛滋病毒。該研究的最重要的發現是從一名HIV-2健康
攜帶者 身上分離到一株同猴免疫缺陷病SIVsm和 SIVmac相類似的病毒(HIV-2/FO784)。在進化分析中,由於FO784同SIVsm/mac的高度同源性,它們相互間在進化樹上已不能被區分開,強烈地提示人類愛滋病毒起源於猴免疫缺陷病毒。這不但為後來的類似實驗所證實,同時大量的流行病學結果也支持這一結論。
首先, 大約有 30%的野生佛羅里達長尾猴感染有SIVsm。大比例的野生猴攜帶有SIV,直接地證明了佛羅里達長尾猴為SIVsm的自然宿主。
第二, SIVsm和 HIV-2共同流行於非洲西部的幾個國家的同一地理區域內。並且共同生活在西非的人和佛羅里達長尾猴有著密切的接觸,例如人們常獵取佛羅里達長尾猴作為寵物或食品。
第三, 感染有SIVsm的佛羅里達長尾猴並不產生任何臨床症狀,可是當把SIVsm接種到恆河猴時,則產生類似於人類的免疫缺陷綜合徵。所有這一切說明SIVsm同佛羅里達長尾猴已形成一種共生關係,即佛羅里達長尾猴已成為SIVsm的自然宿主,並且已不再因為SIVsm的感染而產生任何臨床症狀。可是當SIVsm感染一個新的宿主時則引起在其自然宿主所沒有的臨床表現。同SIVsm感染恆河猴一樣,當SIVsm感染到新的宿主人時,則在感染者產生免疫缺陷綜合徵。因此人類免疫缺陷綜合徵實際上是一種動物傳染病,即一種在自然狀態下由動物傳染到人的疾病。
當然最完善的證明應是獲得直接SIVsm從佛羅里達長尾猴傳播到人的大量流行病學和遺傳學證據。然而在得到這一資料是幾乎不可能的前提下,從人類分離到SIV類似病毒,為HIV起源於猴愛滋病毒提供了最有說服力的證據。HIV—2的D亞型和E亞型同其相應的SIV密切相關,並且在進化分析中同相應SIV形成同一組群,而不能將其同SIV區分開來。這說明至少D和E是通過二次獨立的從猴到人的傳播造成的。2012年已發現至少5種不同的 HIV—2亞型,提示這種在不同種屬間的傳播對HIV—2來講可能至少發生了5次。不久前,在一次意外事件中,一名實驗人員由於沒有嚴格遵守實驗操作條例而感染了SIV。在隨後2年多的追蹤調查中,從該實驗人員體內成功地檢測到病毒和相應抗體,表明該實驗人員已被SIV所感染。該意外事件直接地證明了免疫缺陷病毒從猴類傳播到人類的可能性。
通過上述的研究,對HIV-2的起源有了比較明確的結論。可是對HIV—l的起源問題曾一直是一個未解的迷。雖然說人們普遍認為HIV-l同HIV-2一樣起源於相類似的猴病毒,可是一直缺少明確的證據。儘管已在
黑猩猩 體內成功地分離到一種類似於人類HIV-l的病毒(SIVcpz),可是二者之間的遺傳物質差異很大。同HIV-2和SIVsm/mac的關係不一樣,在遺傳進化的分析中 HIV-l並不同任何SIVcpz形成密切相關的群。另外在自然狀態下,黑猩猩的
感染率 十分的低。幾百隻被篩選的黑猩猩中僅發現有四隻黑猩猩為血清學
陽性 ,這遠低於SIVsm的自然感染率。
人們對HIV-l的起源存在著二種看法:
一種看法認為人類的愛滋病毒起源於SIVcpz,只是還沒有採集到同 HIV—l密切相關的 SIVcpz樣品。然而由於黑猩猩的自然
感染率 非常低,這種可能性不大。
另外一種看法認為人類和黑猩猩的愛滋病毒享有共同的傳染源,然而,最新的實驗結果表明,人類愛滋病I型病毒事實上是起源於非洲的黑猩猩。通過對黑猩猩宿主線粒體的及其所感染的SIV病毒
基因 序列的分析,該研究證明生活在非洲的四類黑猩猩中,有兩類被其相應的SIV所感染。而當今所有流行的 HlV-l僅起源於其中一類生活在中西非國家的黑猩猩,同時2009年7月科學家發現愛滋病毒可使
黑猩猩 大量死亡。
武漢大學 基礎醫學院年輕教授侯煒和武漢大學動物實驗中心霍文哲教授團隊合作的一項科研成果發表在8月份美國著名國際學術刊物《淋巴細胞生物學》雜誌上。這項研究發現,一種名為“表達CD56分子的T淋巴細胞”具有抗愛滋病毒感染的作用。經過3年研究,首次發現“表達CD56分子的T淋巴細胞”培養液中的分泌物可以抑制愛滋病毒的感染和複製,並且這種活性具有廣譜性,既可抑制實驗室保存的愛滋病毒病毒株,也可抑制臨床上分離得到的愛滋病毒病毒株。雖然該培養液中的分泌物對愛滋病毒進入細胞的協同受體影響甚微,但可增強幹擾素調節因子的作用,從而引起巨噬細胞發揮作用,“抗擊”愛滋病毒。
愛滋病毒是如何在人群內在近十幾年來以令人驚奇的速度傳播的,人們對此還沒有明確的回答。但是由於經濟的不斷發展、交通運輸的發達而使人口流動性大幅度的增加、生活習慣的改變無疑在
愛滋病 的流行中起著重要的作用。
劫持細胞 2014年1月,
哈爾濱工業大學 生命學院黃志偉研究組在國際上首次揭示了愛滋病病毒毒力因子Vif的結構,闡明了Vif如何“劫持”人免疫細胞的分子機制,為研製全新愛滋病藥物提供了結構基礎。該研究對人類最終攻克愛滋病具有重要意義和重要的科學套用價值。
作為愛滋病病毒九大基因中至關重要的影響因素,Vif被學界認為是愛滋病病毒在傳播中針對人類進化而生,它通過“劫持”人免疫細胞內蛋白降解系統來降解人免疫細胞內的病毒限制性因子APOBEC3家族成員,從而逃避免疫細胞對愛滋病病毒的識別和防禦。但長久以來,人們對Vif自身或者其功能性複合物的原子水平結構解析並未取得進展。
研究中,黃志偉研究組圍繞Vif這一“頑疾”,重點解析了Vif五元複合物結構,詳細描述了Vif如何“劫持”人CBF-β以及CUL5 E3連線酶複合物的分子機制。該研究分析了愛滋病病毒的結構特徵,了解了愛滋病病毒是怎樣與人結合,為進一步解決愛滋病治療難題提供了可能。依照“按鎖配匙”規律,該研究也為未來愛滋病治療從“雞尾酒式”的混合用藥方式,轉向設計靶向治療藥物開闢了一條新路。
該研究成果論文已在《自然》雜誌線上發表,並作為精選文章在同期《自然》雜誌《新聞與視點》欄目中得到重點推薦。
病毒抗體 南非國立傳染病研究所(NICD)表示,科學家找出能殺死不同愛滋病毒(HIV)株的抗體,有望研發出愛滋病疫苗。
NICD病毒學部主任莫里斯說,科學家從一名婦女的血液樣本,研究她對HIV感染的反應,並且分離出她所產生的抗體。
人體對HIV的反應是產生抗體對抗病毒,在多數情況下抗體無法中和或殺死不同病毒株,但少數廣譜中和性抗體能穿過HIV周圍的防護層殺死病毒。
參與研究的科學家摩爾表示,研究人員已能複製抗體,並將測試是否能在人體沒感染下,發揮免疫功能,
她說:“我們會先進行猴子實驗,成功後才會展開人體試驗。”人體試驗至少還要2年。
激活潛伏 來自 Gladstone 研究所的科學家們在《科學》雜誌上報告稱,他們找到了一種讓潛伏的 HIV 暴露自身的新方法,這或可幫助克服尋求治癒 HIV 感染所面臨的最大的一個障礙。他們發現,無需提高 HIV 基因表達的平均水平,只要提高與 HIV 基因表達相關的隨機活性(噪音),就可以重新激活潛伏 HIV。
當 HIV 感染免疫細胞之時,它會將自身的遺傳物質插入到感染細胞的 DNA 中。在大多數的情況下,免疫細胞的機器裝置會拷貝病毒遺傳物質,最終導致表達生成更多病毒所需的所有元件。新病毒從感染細胞中釋放出來,會擴散感染機體其他的免疫細胞。
然而,在某些情況下, HIV 表達會進入等待模式,感染免疫細胞內的病毒進入到一種潛伏狀態。這意味著有一小部分的 HIV 匿藏在感染細胞中,即便是最有效的藥物也無法觸及它們。
刪除病毒 2014年7月,美國費城的研究人員們發現了一種可以徹底將HIV從人體細胞中刪除的方法,在一項發表在國家科學學術進程雜誌的研究中,研究者首先將一種被稱作核酸酶的DNA剪下酶和一種被稱作指向核糖核酸的目標鏈結合,隨後這個組合便會開始追捕並最終除掉HIV-1的病毒基因組。除掉之後,細胞的基因修復程式開始接管整個過程,將受損的兩端焊接起來,從而得到了一個無病毒的細胞。
由於HIV-1病毒無法被免疫系統清除,只有去除掉病毒才可治癒這種疾病。而這些分子武器也可以當做疫苗使用,武裝上核酸酶-核糖核酸的細胞已被證實不受HIV病毒的感染。
研究室使用一種20核苷酸鏈的指向
核糖核酸 來定位HIV-1病毒,隨後使用一種被稱作 Cas9 的DNA剪下酶來修改人體基因組。研究者已經想出了不同的策略套用到臨床前的研究當中,希望能消除患者身上的每一份HIV-1病毒,才能治癒愛滋病。
治癒案例 2019年3月6日報導,英國首都倫敦一名攜帶愛滋病病毒的男子三年前接受骨髓移植,“繼承”捐贈者的基因突變,超過18個月沒有檢測到愛滋病病毒,有望成為繼“
柏林病人 ”後第二名成功治癒的愛滋病患者。
 人類免疫缺陷病毒
人類免疫缺陷病毒