PCR標記法是在PCR反應底物中,將一種dNTP換成標記物標記成dNTP的一種方法, 這樣標記的dNTP就在PCR反應的同時摻入到新合成的DNA鏈上。這個過程通常以實驗圖的形式展示出來。
基本介紹
- 中文名:PCR標記法
- 外文名:無
- 參考資料:中國生物工程雜誌
- 優點:僅2~3h即可獲高效率標記的探針
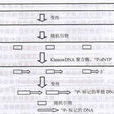
PCR標記法是在PCR反應底物中,將一種dNTP換成標記物標記成dNTP的一種方法, 這樣標記的dNTP就在PCR反應的同時摻入到新合成的DNA鏈上。這個過程通常以實驗圖的形式展示出來。
PCR標記法是在PCR反應底物中,將一種dNTP換成標記物標記成dNTP的一種方法, 這樣標記的dNTP就在PCR反應的同時摻入到新合成的DNA鏈上。這個過程通常以實驗圖的形式...
特異引物的PCR標記所用引物是針對已知序列的 DNA 區段而設計的,具有特定核苷酸序列(通常為 18—24 bp),可在常規PCR復性溫度下進行擴增,對基因組 DNA 的特定...
Southern印跡雜交: 在兩引物之間另合成一條寡核苷酸鏈(內部寡核苷酸)標記後做探針,與PCR產物雜交。此法既可作特異性鑑定,又可以提高檢測PCR產物的靈敏度,還可知其...
是用特異設計的PCR引物擴增目標材料時,由於特定位點的鹼基突變、插入或缺失數很少,以至無多態出現,往往需要對相應PCR擴增片段進行酶切處理,以檢測其多態性。CAPs標記...
PCR產物測序常採用循環測序法:在PCR 反應體系中同時將ddNTP 加人,並利用核素或螢光素標記的引物引導擴增,使模板的擴增與測序同時進行。套用PCR 測序有以下優點:模板...
根據引入螢光標記的類型,常用的實時螢光定量PCR有如下幾種:SYBR Green法、水解探針法( TaqMan法)、雜交探針法以及分子信標法等。1、SYBR Green法...
是1996 年由美國Applied Biosystems 公司推出的一種新定量試驗技術,它是通過螢光染料或螢光標記的特異性探針,標記跟蹤PCR產物進行實時監測反應,利用與之相適應的軟體...
實時螢光定量PCR (Quantitative Real-time PCR)是一種在DNA擴增反應中,以螢光化學物質測每次聚合酶鏈式反應(PCR)循環後產物總量的方法。通過內參或者外參法對待測...
此法已用於多種疾病的點突變的檢測.外文名 ARMS-PCR 基本原理 鹼基不互補...近來又有報導:在ARMS的反應體系中,引物上標記2個不同螢光素,通過對產物螢光...
PCR-RDB法是將特異的探針分別固定到硝酸纖維素膜或尼龍膜上,再將經PCR特異性擴增的產物(在PCR引物5’端預先進行生物素標記,使擴增產物相應標記有生物素)與之雜交...
螢光定量PCR所使用的螢光化學可分為兩種:螢光探針和螢光染料。而螢光定量 PCR 的方法相應的可分為特異類和非特異類兩類,特異性檢測方法是在PCR反應中利用標記螢光...
其PCR擴增原理和普通PCR儀擴增原理相同,只是PCR擴增時加入的引物是利用同位素、螢光素等進行標記,使用引物和螢光探針同時與模板特異性結合擴增。擴增的結果通過螢光信號...
序列標記位點(STS)又稱為序列靶位點。這是一種RFLP技術轉為基於PCR的方法。...... 序列標記位點(STS)又稱為序列靶位點。這是一種RFLP技術轉為基於PCR的方法...
其PCR擴增原理和普通PCR儀擴增原理相同,只是PCR擴增時加入的引物是利用同位素、螢光素等進行標記,使用引物和螢光探針同時與模板特異性結合擴增。擴增的結果通過螢光信號...
5、專一性要求不高的定量PCR檢測。探針法:PCR擴增時在加入一對引物的同時加入一個特異性的螢光探針,該探針為一寡核苷酸,兩端分別標記一個報告螢光基團和一個淬滅...
1.幾種傳統定量PCR方法簡介: 1)內參照法:在不同的PCR反應管中加入已定量的內標和引物,內標用基因工程方法合成。上游引物用螢光標記,下游引物不標記。在模板擴...
採用標記的DNA探針雜交.為了進一步提高檢測的靈敏度,現多在引物和探針的標記上...PCR還可以檢出培養法易發生失敗的病例,從而大大提高菌陰結核病的診斷.另外PCR...
e-PCR 技術是利用生物信息學資料庫作為平台, 藉助相應的分析運算軟體, 搜尋所查詢的DNA 序列(query sequence) 是否含有序列標記位點(Sequence Tagged Sit , STS)...
1983年12月,Mullis用同位素標記法看到了10個循環後的49 bp長度的第一個PCR片段;1985年10月25日申請了PCR的專利,1987年7月28日批准(專利號4,683,202 ),Mullis...
1)內參照法:在不同的PCR反應管中加入已定量的內標和引物,內標用基因工程方法合成。上游引物用螢光標記,下游引物不標記。在模板擴增的同時,內標也被擴增。在...
一般常規使用的標記方法為缺口平移法和隨機引物法,對於人工寡聚核苷酸則採用末端標記法。隨著PCR技術的出現,現在多採用PCR技術,在利用引物擴增核酸探針的同時將探針...
