螢光定量PCR最常用的方法是DNA結合染料SYBR GreenⅠ的非特異性方法和Taqman水解探針的特異性方法,在這裡主要介紹這2種方法,其它方法請參考其它螢光定量PCR資料。
與普通PCR的區別
螢光定量PCR的方法
螢光定量PCR最常用的方法是DNA結合染料SYBR GreenⅠ的非特異性方法和Taqman水解探針的特異性方法,在這裡主要介紹這2種方法,其它方法請參考其它螢光定量PCR資料。

螢光定量PCR(Flurogenic Quantitative Polymerase ChainReaction,FQ-PCR;real-time quantitative PCR, RT-qPCR or qPCR),是1996 年由美國Applied Biosystems 公司推出...
實時螢光定量PCR (Quantitative Real-time PCR)是一種在DNA擴增反應中,以螢光化學物質測每次聚合酶鏈式反應(PCR)循環後產物總量的方法。通過內參或者外參法對待測...
螢光定量PCR最常用的方法是DNA結合染料SYBR GreenⅠ的非特異性方法和Taqman水解探針的特異性方法,在這裡主要介紹這2種方法,其它方法請參考其它螢光定量PCR資料。...
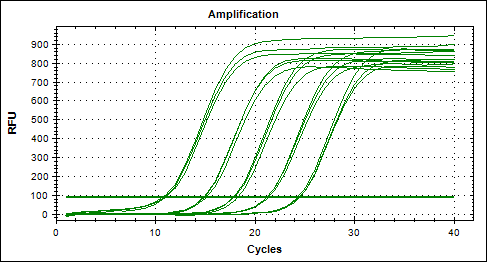
實時螢光定量pcr儀,由螢光定量系統和計算機組成,用來監測循環過程的螢光。與實時設備相連的計算機收集螢光數據。數據通過開發的實時分析軟體以圖表的形式顯示。原始數據...
實時螢光定量PCR技術於1996年由美國Applied Biosystems公司推出,由於該技術不僅實現了PCR從定性到定量的飛躍,而且與常規PCR相比,它具有特異性更強、有效解決PCR污染問題...
簡稱 Q-PCR/qPCR/rt-qPCR、定量即時PCR、即時定量PCR),是一種在DNA擴增反應中,以螢光染劑偵測每次聚合酶鏈鎖反應(PCR)循環後產物總量的方法技術,有廣義概念和...
螢光定量通過螢光染料或螢光標記的特異性的探針,對PCR產物進行標記跟蹤,實時線上監控反應過程,結合相應的軟體可以對產物進行分析,計算待測樣品模板的初始濃度。...
實時螢光定量,是指在PCR反應體系中加入螢光基團,利用螢光信號積累實時監測整個PCR進程,最後通過標準曲線對未知模板進行定量分析的方法。於1996年推出。在螢光定量PCR...
螢光定量PCR檢測儀,是指通過螢光染料或螢光標記的特異性探針,對PCR產物進行標記跟蹤,實時監測反應過程的儀器。結合相應的軟體可以對產物進行定性和定量分析,計算待測...
數字PCR即Digital PCR(dPCR),它是一種核酸分子絕對定量技術。相較於qPCR,數字PCR可讓你能夠直接數出DNA分子的個數,是對起始樣品的絕對定量。...
螢光探針除套用於核酸和蛋白質的定量分析外,在核酸染色、DNA電泳、核酸分子雜交、定量PCR技術以及DNA測序上都有著廣泛的套用。目前,檢測螢光探針的方法主要有單點...
5700型實時螢光定量PCR儀是特異性靶基因檢測與定量的一體化平台,用於醫學實驗。5700將PCR熱循環,螢光檢測和各種套用分析軟體結合在一起,可以動態觀察PCR每一循環各...
Real-Time PCR 技術,又稱實時定量螢光PCR,是指在PCR反應體系中加入螢光基團,利用螢光信號累積實時監測整個PCR進程,最後通過標準曲線對未知模板進行總量分析或通過Ct值...
1、必須擁有標準的的PCR螢光實驗室;實時螢光定量PCR技術於1996年由美國Applied Biosystems公司推出由於該技術不僅實現了PCR從定性到定量的飛躍,而且與常規PCR相比,它...
第四節實時螢光定量PCR的實驗方法60一、實時定量PCR61二、實時定量RT PCR63三、實驗方案的最佳化65四、實踐中應該注意的問題67第五節實時螢光定量PCR技術的套用68...
由Applied Biosystems公司研製的OpenArray System和Fluidigm 公司開發的BioMark System將螢光定量PCR 技術與高通量晶片技術相結合,屬於高通量PCR 晶片,但這些晶片必須在...
《PCR最新技術原理、方法及套用》是2011年化學工業出版社出版的圖書,作者是黃留玉...諸如致突變PCR、免疫PCR、實時螢光定量PCR和PCR在法醫學中的套用等章節進行補充...
目前常用的技術,可以將一段基因複製為原來的一百億至一千億倍。根據DNA擴增的目的和檢測的標準,可以將PCR儀分為普通PCR儀,梯度PCR儀,原位PCR儀,實時螢光定量PCR儀...
是利用PCR(Polymerase chain reaction,聚合酶鏈反應)技術對特定DNA擴增的一種儀器...的標準,可以將PCR儀分為普通PCR儀,梯度PCR儀,原位PCR儀,實時螢光定量PCR儀四...
背景知識螢光定量PCR技術是通過螢光染料或螢光標記的特異性探針,對PCR產物進行標記跟蹤,實時監控反應過程。隨著PCR 反應的進行,反應產物不斷累積,螢光信號強度也等比例...
臨床上最先進的B肝病毒DNA檢測方法是實時螢光定量PCR方法,由於此技術要求較高,只有少數大型醫院有條件使用實時螢光定量PCR方法。B肝病毒DNA檢測檢測報告 編輯 1、...
