定量原理 實時螢光定量PCR是利用螢光信號的變化,實時檢測PCR擴增反應中每次循環擴增產物量的變化,通過循環閾值和標準曲線的分析對標本中起始模板拷貝數進行定量分析。在實時螢光定量P(R進程中,每次循環進行一次螢光信號的收集,以螢光強度為縱軸,循環次數為橫軸,所得到的曲線稱為PCR擴增曲線(圖1)。在前面十多次循環中,雖然目標產物呈指數增加,但其引發的螢光總強度未達到儀器的檢測限,所以儀器檢測到的螢光強度無變化,該時間段螢光強度的平均值稱為基線。當螢光信號達到一定強度後,螢光強度的増加才能夠如實地被檢測儀器檢測到。能夠被儀器檢測到的最小螢光強度稱為螢光閾值,圖中螢光閾值為0.11。實際情況下,螢光閾值可人為設定,通常取第3~15次循環的螢光強度均值加10倍標準差,也可採用陰性對照螢光值的最高點。PCR擴增過程中,擴增產物的螢光信號達到設定的閾值時所經過的擴增循環次數稱為循環閾值,圖1中Ct 1、Ct 2、Ct 3分別為三個樣品的循環閾值。
圖1 Ct 值與反應管內的模板量(拷貝數)相關,與該模板的起始拷貝數的對數存線上性關係。起始拷貝數越多,Ct 值越小。採用已知起始拷貝數的模板,在相同條件下進行擴增,測得其Ct 值,以Ct 值為縱坐標,起始模板拷貝數的對數值為橫坐標,製作標準曲線。對於模板量未知的樣品,只要在相同條件下測得其Ct 值,即可從標準曲線上査出該樣品的起始拷貝數的對數值,進而換算得到樣品中的模板拷貝數。
分類 根據引入螢光標記的類型,常用的實時螢光定量PCR有如下幾種:SYBR Green法、水解探針法( TaqMan法)、雜交探針法以及分子信標法等。
1、SYBR Green法
SYBR Green是一種螢光染料,在PCR的反應體系中加入過量 SYBR Green螢光染料,該染料特異性地摻入DNA雙鏈後,發出螢光信號,而未摻入鏈中的SYBRGreen染料分子不發出任何螢光信號。PCR產物越多,螢光越強,螢光信號的增加與PCR產物的增加同步。由於只有退火和延伸時才形成雙鏈DNA,SYBR Green染料才會結合到雙鏈DNA而發出螢光信號,因此螢光信號的採集應該在這兩個階段進行SYBR Green法可以用於各種擴增產物的定量,只要最後產物是雙鏈DNA。這既是SYBR Green法的主要優點,也是主要缺陷,即SYBR Green法不能區分擴增產物的特異性,只要是雙鏈DNA,或者單鏈核酸中存在部分雙鏈結構,結合SYBR Green後都會發出螢光信號。為了克服該缺陷,可配合PCR產物
熔解曲線 的分析:如果熔解曲線得到單一峰,一般認為無非特異性擴増,用該方法定量準確;如果熔解曲線岀現雜峰,提示以此定量不準確。
2、TaqMan法
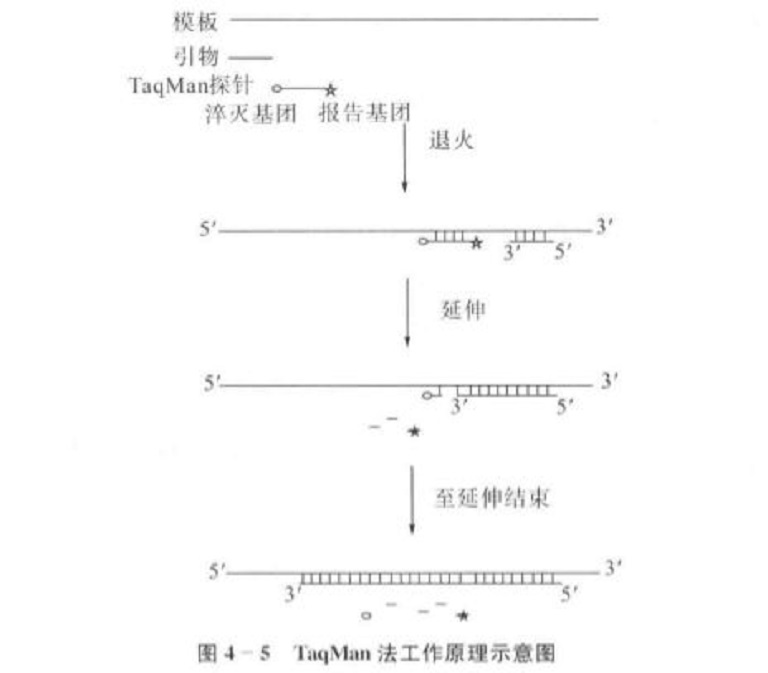
TaqMan法使用TaqMan探針與擴增產物中的靶基因序列雜交,從而提高產物檢測的特異性,即使擴增產物中存在非特異性擴增片段,只要不與探針互補結合,就不會對螢光定量產生影響。TaqMan探針序列與擴增目的片段的一段互補,5′端標以螢光報告基團,3端標以螢光淬滅基團。TaqMan探針的3′端經過磷酸化處理,可防止探針在PCR擴増過程中被延伸。當探針保持完整時,螢光報告基團發出的螢光被淬滅基團吸收,報告基團的螢光信號不能被檢測到;當螢光報告基團與淬滅基團發生分離,螢光報告基團發出的螢光信號就能被系統檢測到。可用於標記TaqMan探針的螢光報告基團有羧基螢光素(FAM)、四氯螢光素(TET)、羧基-4,5-二氯-2′,7′-二甲氧基螢光素(JOE)、六氯螢光素(HEX)等;淬滅基團有5-羧基四甲基羅丹明(TAMRA)和4-(4′-二甲基氨基偶氮苯基)苯甲酸(DABCYI)。在PCR退火時,引物和探針均可結合到靶基因模板上;在延伸階段,隨引物延伸。Taq酶沿DNA模板移動,當移動到TaqMan探針位置時,Taq酶利用其5-3外切酶活性水解切斷探針,釋放出螢光報告基團,使螢光報告基團與淬滅基團分離,淬滅作用被解除,螢光報告基團釋放螢光信號(圖4-5)。每次循環新增的螢光信號與靶序列數量一致
TaqMan法需要利用Taq酶的5′~3外切核酸酶活性,在延伸過程中水解探針釋放螢光信號。在60℃時,Taq酶的5′→3′外切核酸酶活性最高,因此TaqMan法一般採用60℃延伸。設計引物與探針時,應使探針與模板結合部位儘量靠近引物與模板結合的部位,探針的T值要適當高於引物的TM值,通常高5℃左右,以保證探針與模板結合的穩定程度大於引物與模板結合的穩定程度。探針的TM值最好為68~70℃長度小於30bp;5端不能有鹼基G,因為G可能會淬滅螢光素。為了使檢測結果更準確可靠,需要對引物、探針、PCR其他要素以及擴增循環條件進行最佳化。
圖2 與SYBR Green法相比,TaqMan法的優勢在於特異性高,探針設計相對簡單,重複性比較好;其缺點是一個探針只適合檢測一個特定的靶序列,且由於探針在反應過程中被水解,為保證探針足夠,需在體系中加入較多探針,導致成本增加,且本底螢光值較高(淬滅不徹底)。為解決 TaqMan探針本底螢光值高的問題,科學家在傳統TaqMan探針基礎上設計了一種新型探針-TaqMan MGe探針。MGB意為小溝結合物( Minorgroove binder),能與DNA雙螺旋的小溝結合。 TaqMan M(B探針中的MGB連線於探針的3′端,可摺疊伸進由探針末端5或6個核苷酸形成的小溝,提髙探針的T。值使探針與模板的雜交穩定性大大提髙,使較短的探針同樣能有較髙的T值,而短探針的螢光報告基團和淬滅基團的距離更近,淬滅效果更好,本底螢光值更低。除增加MGB分子外,TaqMan MGB探針與傳統的 TaqMan探針的不同之處還在於其3端的淬滅基團為非螢光性基團,其吸收螢光報告基團的能量後並不發光,大大降低了本底信號的干擾。
3、雙雜交探針法
雙雜交探針是根據螢光共振能量轉移原理設計的。該法反應體系中有2條特異性探與靶序列互補結合後幾乎首尾相連,探針1的3′端與探針2的5端相隔1~5個核苷酸。在探針1的3′端、探針2的5端分別標記螢光供體基團和螢光受體基團。在退火階段探針與模板雜交時,兩種探針互相靠近,實現螢光共振能量轉移。螢光供體基團接受激發,並將得到的能量傳給螢光受體基團,使其發射特定波長的螢光,被系統檢測到。只有當兩條探針都與靶序列正確雜交時才可能檢測到螢光受體基團的螢光信號,因此,該方法本底螢光值更低,特異性更高。螢光信號的採集應在退火後進行。雙雜交探針法工作原理如圖3所示。
圖3 4、分子信標法
分子信標是一結構特殊的單鏈核酸探針,分為環狀區和莖幹區,兩端分別結合螢光發射基團和螢光淬滅基團,如圖4-7所示。分子信標的環狀區與待檢測靶基因序列互補,長度一般為15~30個鹼基;莖幹區由探針分子兩端的數個互補配對的鹼基組成,通常為5~8對。當體系中不存在靶基因時,分子信標以莖環結構存在,螢光發射基團和螢光淬滅基團互相靠近,不產生螢光;當存在靶基因時,在退火階段,分子信標與靶基因雜交,其莖幹區被打開,螢光發射基團遠離螢光淬滅基團,發岀螢光信號;延伸結束,分子信標又恢復莖環結構,螢光又被淬滅。分子信標法螢光背景信號低,靈敏度高;不足之處是雜交時探針不能完全與模板結合,因此穩定性差,且探針合成時標記較複雜。
檢測模式 PCR過程的監測有多種檢測模式。最常用的有三種檢測模式:
⑴SYBR Green I 檢測模式。溫度循環為94-55-72°C三步法,只有
引物 ,無探針,
螢光染料 鑲嵌在雙股螺旋鏈中間。通過對特定方向的強螢光檢測獲得信號,這種試劑檢測模式易產生非特異信號,且本底光較大。
⑵水解探針(Taqman Hydrolysis Probes)模式。溫度循環為94-60°C二步法,不僅有
引物 ,還有另外一個特異針對擴增模板的探針在引物對之間。在探針相鄰兩個鹼基上分別結合兩個
螢光染料 ,一個染料接受激發光得到的
能量 傳給了第二個染料,接受能量的第二個染料通過發射特徵光子回到
穩定態 。當Taq酶在60°C延伸擴增鏈時,遇到探針,利用Taq酶5`-3`外切酶活性將探針水解成單個鹼基,單個鹼基之間距離較遠,第一個染料的
能量 無法傳給第二個染料,只好通過發射特徵光子回到
穩定態 ,通過對溶液中第一個染料的螢光檢測獲得信號。這種試劑檢測模式增加了檢測信號的
特異性 ,但是由於利用了Taq酶5`-3`外切酶活性,一般試劑廠家只給Taq酶的聚合酶活性定標,沒有同時給Taq酶5`—3`外切酶活性定標,不同
批號 試劑之間會給定量帶來差異。另外對探針的熔點溫度(Tm)僅要求其高於60°C,這就使不同試劑盒之間的特異性參差不齊,而且無法做質控檢測。
⑶雙
雜交探針 (Hybridization Probes)模式。溫度循環為94-55-72°C三步法,有
引物 ,二個特異針對擴增模板相鄰的探針在引物對之間,在一個探針3`
鹼基 上結合一個
螢光染料 ,在另一個探針5`鹼基上結合第二個螢光染料。在55°C時,兩個探針都剛好接合在模板上,第一個染料接受激發光得到的
能量 傳給了第二個染料,接受能量的第二個染料通過發射特徵光子回到穩定態,通過對結合在擴增模板上雙探針中第二個染料的螢光檢測獲得信號。這種試劑檢測模式中
螢光 信號與特定雜交溫度相關,探針的濃度始終保持不變,因此可以在擴增後檢測熔解曲線作為信號的特異性質控。另外這種試劑檢測模式可以用於點突變檢測。
特點 實時螢光定量PCR由於螢光物質的套用,可以通過光電傳導系統直接探測PCR擴增過程中螢光信號的變化以獲得定量結果,克服了常規PCR的許多缺點,具有如下優勢:①能對模板定量;②封閉反應,無需PCR後處理,污染少,假陽性率低;③觀察和記錄自動化,結果直觀,避免人為判斷帶來的誤差;④工作效率高,利於實現高通量檢測。
實時螢光定量PR的缺點表現:①需要特殊設備以及螢光探針,成本較高;②不能顯示PCR產物的片段長度;③定量準確性還有待提高。
關鍵點 RT-qPCR影響分析可靠性關鍵點:
1.分析結果依賴於模板的數量、質量以及合理的檢測方法設計
3.數據分析應該高度客觀,如果不合理的分析,從分析結果中會得到混淆的錯誤結果,因此通過對RT-q
PCR 的每一
組分 進行質量評價以達到最小化變異性,最大化可重複性,而且還需要沿用一個通用的數據分析的指南。對
基因表達 分析的標準化的需要是與人類臨床診斷分析相適應的。
由於各個學術團體和科研機構使用不同的操作流程,必然導致大家使用不同定量的來源物以及數據分析:
1.新鮮、冰凍、甲醛固定的樣品
2.整個組織樣本,顯微切割樣本,單個細胞,組培細胞
3.總RNA或者mRNA
4.RNA反轉錄成cDNA的不同的引發策略
5.不同的酶以及酶的不同組合
7.多類型的檢測化學方法,反應的條件,熱循環儀的分析以及匯報方式。
8.每一步驟缺乏標準化分析流程造成了在
樣品 的處理,內參的使用,
歸一化 的方法,質量控制等等因素嚴重影響RT-q
PCR 的可信度,重複性。
最佳化方式 2.建議使用SYBR Green I和EvaGreen 進行擴增和溶解曲線的測試
Real Time PCR操作流程 主要操作流程:
1.針對目的基因序列選擇合適的擴增片斷,設計引物。
DNA 引物 長度:15-25 個
鹼基 GC含量:50%左右如果
引物 的與AT區域富集結合,可以考慮用LNA替換幾個鹼基,較少引物的長度以及避免引物次級結構和3’端二聚體的影響.由於引物和模板和探針與靶點之間的分之間的相互競爭,分之內雜交,倒轉重複等等會引起引物的引發探針對結合效率達降低,因此我們選擇引物二聚體的△G為負值,即:<10 kcal/mol.沒有連續的G/C。引物探針的保存一般遵循以下原則:正向和反向引物保存在-20度,濃度為10mM 或者10×工作濃度.探針應該避光保存,貯存在-70度,最好以凍乾粉狀態,工作濃度的液體保存一般兩周左右。
2.輸入靶序列,用進行比對;
3.檢查比對序列的多態性以及可能的錯誤避免這些區域來進行引物和探針設計;
4.在靶序列中避免直接待重複區,在重複區進行雜交容易使得
引物 非獲得產物性結合,降低DNA的擴增效率以及減少分析的靈敏度;
5.考慮到潛在的剪接
變異體 以及合適的所需要的獲得到靶,通過學分析內含子以及
外顯子 的邊界,主要通過cDNA和基因組序列比對來確定。一般都設計跨最長內含子區,這樣減少了
擴增子 受到
基因組DNA 的污染的影響。這是十分有必要的,特別當用DNA做
歸一化 處理以及
靶向 某一特異的剪接
變異體 。最經濟的做法是讓下游引物跨越
剪接接頭 ,這樣允許使用一條探針檢測可能剪接
變異體 .然後如果在有效性和靈敏度無法保證情況下,可以使用跨越單一
外顯子 的設計方案。我們還是建議試驗者用DnaseI處理樣品,除去gDNA的污染;
6.在RT步驟時,用工具檢測在特定溫度下靶序列的摺疊情況,避免一些高度次級結構的區域,那些區域探針和引物結合效率較低。
 圖1
圖1 圖2
圖2 圖3
圖3 Real Time PCR操作流程
Real Time PCR操作流程