硝酸(nitric acid)分子式為HNO3,是一種有強氧化性、強腐蝕性的無機酸,酸酐為五氧化二氮。硝酸的酸性較硫酸和鹽酸小(PKa=-1.3),易溶於水,在水中完全電離,常溫下其稀溶液無色透明,濃溶液顯棕色。硝酸不穩定,易見光分解,應在棕色瓶中於陰暗處避光保存,嚴禁與還原劑接觸。硝酸在工業上主要以氨氧化法生產,用以製造化肥、炸藥、硝酸鹽等。
基本介紹
- 中文名:硝酸
- 外文名:nitric acid
- 性質:有刺激性氣味的液體
- 分子式:HNO3
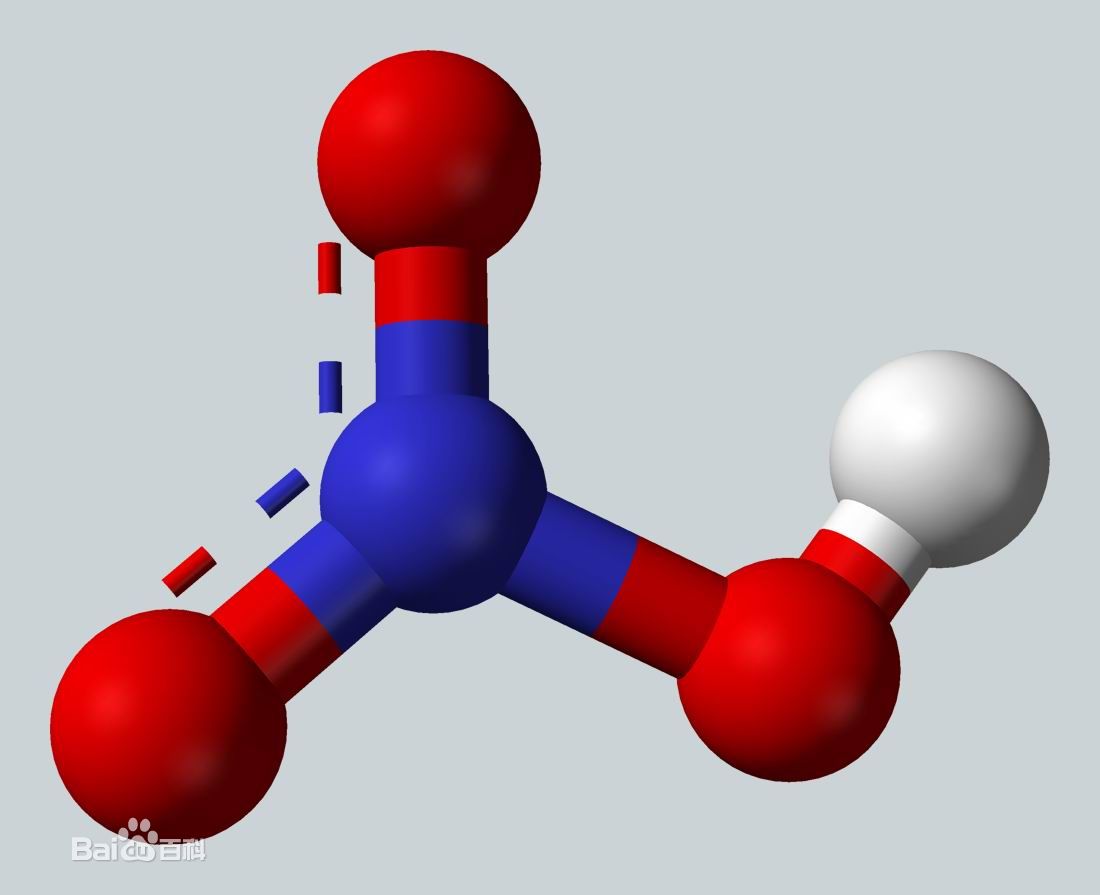
硝酸(nitric acid)分子式為HNO3,是一種有強氧化性、強腐蝕性的無機酸,酸酐為五氧化二氮。硝酸的酸性較硫酸和鹽酸小(PKa=-1.3),易溶於水,在水中完全電離,常溫下其稀溶液無色透明,濃溶液顯棕色。硝酸不穩定,易見光分解,應在棕色瓶中於陰暗處避光保存,嚴禁與還原劑接觸。硝酸在工業上主要以氨氧化法生產,用以製造化肥、炸藥、硝酸鹽等。
硝酸(nitric acid)分子式為HNO3,是一種有強氧化性、強腐蝕性的無機酸,酸酐為五氧化二氮。硝酸的酸性較硫酸和鹽酸小(PKa=-1.3),易溶於水,在水中完全電離,...
硝酸是一種具有強氧化性、腐蝕性的強酸,屬於一元無機強酸,是六大無機強酸之一,也是一種重要的化工原料。在工業上可用於制化肥、農藥、炸藥、染料、鹽類等;在有...
分子式為HNO3,純HNO3是無色有刺激性氣味的液體,市售濃硝酸質量分數約為68%,密度約為1.4g/cm3,沸點為83℃,易揮發,可以任意比例溶於水,混溶時與硫酸相似會釋放...
硝酸工業已經逐漸發展起來,這個工業減少了對環境的污染,合理地利用了資源,使我國的經濟不斷發展。...
共沸蒸餾稀硝酸濃縮法auper2xenlr}pie distillation pro-ce7} fnr dilute nitrsc arid conrcntrataon濃硝酸生產方法之一氨和空氣經過濾後,混合,進人氨氧化爐,...
硝酸濃縮塔rutrir acid evncentratinn tower稀硝酸在塔 內脫水製成濃硝酸的設備。塔體為矽鐵或其他耐腐蝕材料制 成的圓筒。內部結構多為填料型 稀硝酸與脫水劑進...
2018年5月28日,湖北省黃岡市一藥業公司的硝酸貯槽中的稀硝酸泄漏,在空氣中形成大量黃色煙霧。環保人員對現場空氣和水環境進行布點取樣,檢測結果表明未對空氣和水...
硝酸根是指硝酸鹽的陰離子,化學式:NO₃﹣,硝酸根為-1價,其中N為最高價+5價。...... 一般還與稀硝酸配合用於檢驗。在有機化學中,硝酸根可以用於生成硝酸酯...
硝酸咪康唑屬抗真菌藥。本品在4mg/L濃度時可抑制大部分真菌生長,芽生菌屬、組織漿胞菌屬對其呈現高度敏感,隱球菌屬、念珠菌屬、球孢子菌屬等亦對本品敏感。...
硝酸益康唑為白色或微黃色的結晶或結晶性粉末,無臭,屬於抗真菌藥。硝酸益康唑常用於硝酸益康唑中硝酸益康唑的測定,根據本液的消耗量與鄰苯二甲酸氫鉀的取用量...
綜合法硝酸工藝atmospheric combination and low pres-sure absorption nitric acid proce、生產稀硝酸方法之一。氨氧化過程為常壓,酸吸收過程在加壓下進行。氨和空氣...
常壓硝酸工藝atmnspheri} nitric acid pr}xess生產稀硝酸方法之一。系指氧化、吸收全過程均在常壓下進行。氨和空氣經過濾後,混合。混合氣中氨濃度為1t1%一12 9...
間接法生產濃硝酸工藝 稀硝酸經脫水劑作用,製取濃硝酸。方法有二:(1)硫酸濃縮法:以濃硫酸為脫水劑。將約55%硝酸與93%硫酸,分別送入濃縮塔,塔底有再沸器供熱...
中壓法硝酸工藝medium-pressure nitric acid process生產稀硝酸方法之一。氧化和吸收全過程均在0.4--U.511'ff'。壓力下進行。氨經過濾、過熱後與壓縮機出u o....
雙加壓硝酸工藝(dual-pressure nitric acid process),稀硝酸生產方法之一,法國GP公司(Grande Paroisse Engineering Corporation)的研究成果。氨氧化過程為中壓,NOx吸收...
硝化方法主要有:稀硝酸硝化、濃硝酸硝化、在濃硫酸中用硝酸硝化、在有機溶劑中用硝酸硝化和非均相混酸硝化等。硝化方法主要有以下幾種:(1)稀硝酸硝化一般用於...
我們知道,鐵、鋁在稀HNO3或稀H2SO4中能很快溶解,但在濃HNO3或濃H2SO4中溶解現象幾乎完全停止了,碳鋼通常很容易生鏽,若在鋼中加入適量的Ni、Cr,就成為不鏽鋼了...
有還原性,易被濃,稀硝酸,濃硫酸所氧化而溶解: CuS+8HNO3(濃)===CuSO4+8NO2↑+4H2O 3CuS+8HNO3(稀)===3CuSO4+8NO↑+4H2O CuS+4H2SO4(濃)===Cu...
