親電取代反應(electrophilic substitution reaction)是指化合物分子中的原子或原子團被親電試劑取代的反應。最重要的親電取代反應是苯環上的親電取代反應一一芳香親電取代反應。
基本介紹
- 中文名:親電取代反應
- 外文名:electrophilic substitution reaction
反應歷程
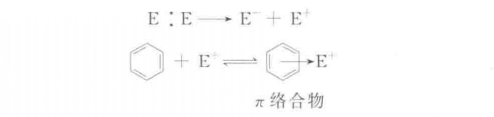
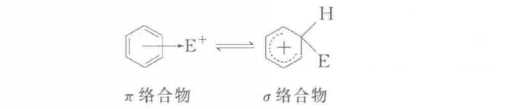
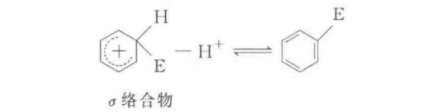
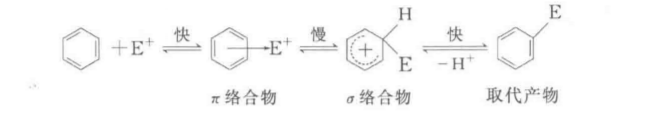
主要反應
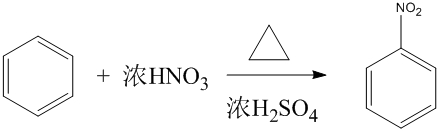 硝化反應
硝化反應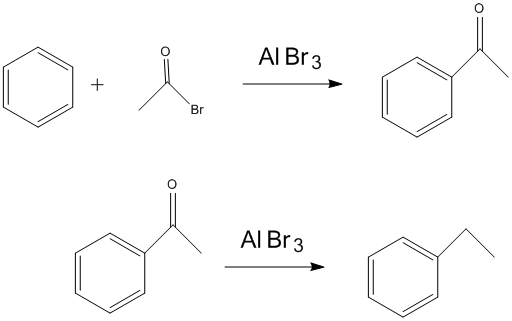 醯基化及還原
醯基化及還原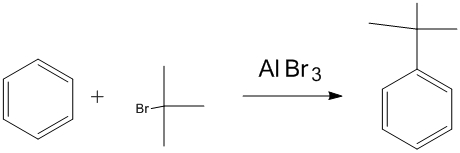 烷基化反應
烷基化反應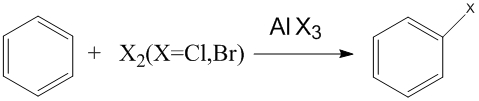 鹵化反應
鹵化反應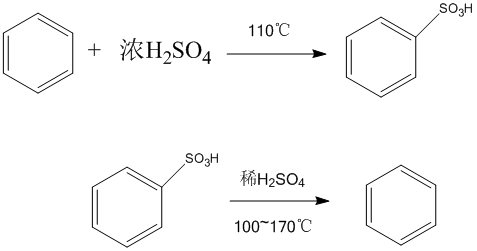 磺化反應
磺化反應親電取代反應(electrophilic substitution reaction)是指化合物分子中的原子或原子團被親電試劑取代的反應。最重要的親電取代反應是苯環上的親電取代反應一一芳香親電取代反應。


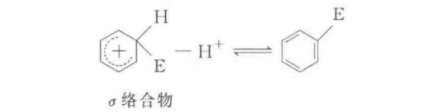

 硝化反應
硝化反應 醯基化及還原
醯基化及還原 烷基化反應
烷基化反應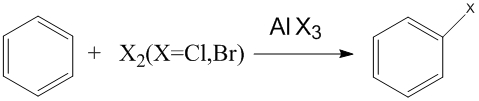 鹵化反應
鹵化反應 磺化反應
磺化反應親電取代反應(electrophilic substitution reaction)是指化合物分子中的原子或原子團被親電試劑取代的反應。最重要的親電取代反應是苯環上的親電取代反應一一芳香親電...
親電取代反應一種親電試劑取代其它官能團的化學反應,這種被取代的基團通常是氫,但其他基團被取代的情形也是存在的。親電取代是芳香族化合物的特性之一,因此一般稱...
取代反應(substitution reaction)是指化合物或有機物分子中任何一個原子或原子團被試劑中同類型的其它原子或原子團所替代的反應,用通式表示為:R-L(反應基質)+A-...
由單環芳烴的親電取代反應可以看出,當芳環上已有取代基時,新引入基團是否容易,進入哪個位置,主要由芳環原來取代基的性質所決定。我們把芳環上原來具有的取代基...
親電取代反應也可分為兩種機制,即單分子親電取代SE1和雙分子親電取代SE2,這與脂肪親核取代反應可分為SN1和SN2是類似的。SE1反應是分步進行的,反應物首先離解成...
親電反應指缺電子(對電子有親和力)的試劑進攻另一化合物電子云密度較高(富電子)區域引起的反應。親電反應屬於離子型反應(ionic reaction)的一種,是有機化學的...
親電取代反應也可分為兩種機制,即單分子親電取代SE1和雙分子親電取代SE2,這與脂肪親核取代反應可分為SN1和SN2是類似的。...
取代是指有機分子裡的某些原子或原子團通過化學反應被其他原子或原子團所替代。包括親核取代和親電取代。...
親電性,指某物質具有從其他分子或離子獲得電子或與其他分子或離子分享電子的性質。有親電試劑參與的反應,均為親電子反應,如親電子催化反應,即催化劑從反應物取得...
苯與溴的取代反應是指苯分子中一個原子被溴取代的反應。鹵素分子在苯和催化劑的共同作用下異裂,X進攻苯環,X與催化劑結合。詳細解釋查看芳族取代反應。...
同一族(或同一組)反應物中各種不同取代基對其熱力學性質(如平衡常數等)和動力學參數(如反應速率常數等)的影響。反應物分子中的一個基團被另一基團所取代的反應...
鹵代反應是指鹵素取代烴基上的氫原子或羥基等官能團的反應。較常用的鹵代反應可分為四類:烷烴鹵代反應、苯環鹵代反應、芳雜環鹵代反應、羰基α 氫原子的鹵代...
有機反應(organic reaction)即涉及有機化合物的化學反應,是有機合成的基礎。幾種基本反應類型為:取代反應、加成反應、消除反應、周環反應、重排反應和氧化還原反應...
芳香族化合物硝化的反應機理為:硝酸的-OH基被質子化,接著被脫水劑脫去一分子的水形成硝醯正離子(nitronium ion,NO2)中間體,最後和苯環行親電芳香取代反應,並...
Vilsmeier-Haack反應,含有活潑芳環的芳香族化合物與二取代甲醯胺磷醯氯在催化劑(一般是三氯氧磷即:POCl3)的作用下,在芳環上發生甲醯化的反應稱為Vilsmeier反應,...
苯分子等芳香烴化合物里的氫原子被硫酸分子裡的磺酸基所取代的反應。 磺化反應過程 一種向有機分子中引入磺酸基或磺醯氯基的反應過程。磺化過程中磺酸基取代碳...
由於它們的高度活潑性以及呋喃和吡咯對於無機強酸的敏感性,其親電取代反應需要比較溫和的條件。例如,呋喃和吡咯進行磺化時要用吡啶-三氧化硫加成物;如用硫酸,環將...
