鹵化反應簡介
在有機化合物分子中引入鹵原子,形成碳-鹵鍵,得到含鹵化合物的反應被稱為鹵化反應。根據引入鹵原子的不同,鹵化反應可分為氯化、溴化、碘化和氟化。其中以氯化和溴化更為常用,氯化反應的套用尤為廣泛。鹵化已廣泛用於醫藥、農藥、染料、香料、增塑劑、阻燃劑等及其中間體等行業,製取各種重要的原料、精細化學品的中間體以及工業溶劑等,是有機合成的重要崗位之一。
通過向有機化合物分子中引入鹵素,主要有兩個目的:
①賦予有機化合物一些新的性能,如含氟氯嘧啶活性基的活性染料,具有優異的染色性能。
②在製成鹵素衍生物以後,通過鹵基的進一步轉化,製備一系列含有其他基團的中間體,例如,由對硝基氯苯與氨水反應可製得染料中間體對硝基苯胺,由2,4-二硝基氯苯水解可製得中間體2,4-硝基苯酚等。
由於被鹵化脂肪烴、芳香烴及其衍生物的化學性質各異,鹵化要求不同,鹵化反應類型也不同。鹵化方法分為:
①取代鹵化,如烷烴和芳香烴及其衍生物的鹵化。
②加成鹵化,如不飽和烴類及其衍生物的鹵化。
③置換鹵化,如有機化合物上已有官能團轉化為鹵基。
鹵化反應原理
取代鹵化主要有芳環上的取代鹵化、芳環側鏈及脂肪烴的取代鹵化。取代鹵化以取代氯化和取代溴化最為常見。
芳環上的取代鹵化是親電取代反應,其反應通式為
Ph-H +X2→Ph-X+HX
這是精細有機合成中的一類重要的反應,可以製取一系列重要的芳烴鹵化衍生物。例如:
這類反應常用
三氯化鋁、三氯化鐵、三溴化鐵、四氯化錫、氯化鋅等Lewis酸作為催化劑,其作用是促使鹵素分子的極化離解。
芳環上的取代鹵化一般屬於離子型親電取代反應。首先,由極化了的鹵素分子或鹵正離子向芳環做親電進攻,形成σ-絡合物,然後很快失去一個質子而得鹵代芳烴。
鹵化的目的
(1)可改善染色性能,提高染料的染色牢度。如四溴靛藍的牢度比
靛藍好,色澤更加鮮艷,牢度好。
(2)通過鹵基(主要是—Cl、—Br)水解、醇解和氨化引入其他基團,主要是—OH、—OR和—NH2。
(3)通過鹵基,進行成環
縮合反應,進一步合成染料。
影響因素
影響反應的主要因素主要有以下幾種:
①芳烴取代基。芳環上取代基的電子效應對芳環上的取代鹵化的難易及鹵代的位置均有很大的影響。芳環上連有給電子基,鹵代反應容易進行,且常發生多鹵代現象,需適當地選擇和控制反應條件,或採用保護、清除等手段,使反應停留在單、雙鹵代階段。
芳環上若存在吸電子基團,反應則較困難,需用Lewis酸催化劑在較高溫度下進行鹵代,或採用活性較大的鹵化試劑,使反應得以順利進行。若芳環上除吸電子基團外還有給電子基團,鹵化反應就順利多了。
萘的鹵化比苯容易,可以在溶劑或熔融態下進行。萘的氯化是一個平行一連串反應,一氯化產物有曠氯萘和伊氯萘兩種異構體,而二氯化的異構體最多可達10種。
②鹵化試劑。直接用氟與芳烴作用製取氟代芳烴,因反應十分激烈,需在氬氣或氮氣稀釋下於-78℃進行,故無實用意義。
合成其他鹵代芳烴用的鹵化試劑有鹵素(SOCl2)等。若用碘進行碘代反應,因生成的烴,所以需同時加氧化劑,或加鹼,或加入能與除去,方可使碘代反應順利進行。若採用強碘、N-溴(氯)代丁二醯亞胺(NBS)、次氯酸、硫醯氯碘化氫具有還原性,可使碘代芳烴還原成原料芳碘化氫形成難溶於水的碘化物的金屬氧化物將其化劑ICl進行芳烴的碘代,則可獲得良好的效果。
③介質。常用的介質有水、鹽酸、硫酸、醋酸、氯仿及其他鹵代烴類化合物。反應介質的選取是根據被鹵化物的性質而定的。對於鹵化反應容易進行的芳烴,可用稀鹽酸或稀硫酸作介質,不需加其他催化劑;對於鹵代反應較難進行的芳烴,可用濃硫酸作介質,並加入適量的催化劑。
另外,反應若需用有機溶劑,則該溶劑必須在反應條件下顯示惰性。溶劑的更換常常影響到鹵代反應的速度,甚至影響到產物的結構及異構體的比例。一般來講,採用極性溶劑的反應速度要比用非極性溶劑快。
④反應溫度。一般情況下,反應溫度越高,則反應速度越快,也容易發生多鹵代及其他副反應。故選擇適宜的反應溫度亦是成功的關鍵。對於取代鹵化反應而言,反應溫度還影響鹵索取代的定位和數目。
類型
1.取代鹵化
(1)芳環上的取代鹵化
芳環上的取代鹵化,可製取許多有用的芳烴鹵化衍生物,如氯苯、溴苯、碘苯、鄰或對氯甲苯、鄰氯對硝基苯胺、2,4一二氯苯酚、四溴雙酚A、四氯蒽醌等。反應通式為:
Ar-H +X2—→Ar-X +HX
式中,Ar-H為芳香烴及其衍生物;Ar-X為芳香烴及其衍生物的鹵化產物;X2為鹵素;HX為鹵化物。
(2)脂肪烴的取代鹵代
烷烴取代鹵化常以鹵素為鹵化劑,在高溫或紫外光照射下,進行氣相鹵化。鹵素活潑性越高,反應越激烈,反應選擇性越低。
鹵素活潑性的次序為:F>Cl>Br>I
氟化反應難以控制、難以獲得期望的產物;碘的活性太低,脂肪烴取代鹵化,套用最多是烷烴取代氯化和溴化。
烷烴取代氯化,取代氫的位置與C-H鍵斷裂能量有關,其能量順序為:
CH2═CH—H》1°C—H》2°C—H>3°C—H》H—CH2—CH═CH2
被取代氫的活潑順序,則與此相反。
烷烴取代鹵化屬自由基反應,包括鏈引發、鏈增長和鏈終止階段。鹵分子一旦被激發,產生一定量的鹵自由基後,反應就會迅速進行。
2.加成鹵化
(1)鹵素與烯烴的加成
氟是鹵素中最活潑的元素,它與烯烴的加成反應非常劇烈,並有取代、聚合等副反應伴隨發生,易發生爆炸,故在有機合成上無實用意義。
碘的化學性質不活潑,與烯烴加成相當困難,且生成的碘化物熱穩定性、光穩定性都比較差,反應是可逆的,所以套用亦很少。
氯、溴與烯烴的加成在有機合成上套用廣泛。
烯烴的π鍵具有供電性,鹵素分子受兀鍵影響發生極化,其正電部分作為親電試劑,對烯烴的雙鍵進行親電進攻,生成三元環鹵翁離子。然後,鹵負離子從環的背面向缺電子的碳正離子做親核進攻,結果生成反式加成產物。
(2)鹵化氫與烯烴的加成
氟化氫、氯化氫、碘化氫與烯烴的加成,以及在隔絕氧氣和避光的條件下,溴化氫與烯烴的加成,均屬於離子型親電加成反應。反應結果生成相應的鹵代飽和烴,加成定位方向遵守馬氏規則。鹵化氫的反應活性順序為:
HI> HBr> HCI> HF
3.置換鹵化
鹵原子能夠置換有機物分子中與碳原子相連的羥基、磺酸基及其他鹵原子等多種官能團,這些鹵置換反應已成為鹵代烴的重要合成方法。
(1)醇羥基的鹵置換
醇羥基的鹵置換反應通式為
ROH +HX—→RX+H2O(X=Cl、Br、I)
醇與氫鹵酸的反應是可逆的。若使醇或氫鹵酸過量,並不斷地將產物或生成的水從平衡混合物中移走,可使反應加速,產率提高。去水劑有硫酸、磷酸、
無水氯化鋅、氯化鈣等,亦可採用恆沸帶水劑。
(2)酚羥基的鹵置換
酚羥基的活性較小,由酚製備氯代芳烴,一般需用強鹵化試劑在較劇烈的條件下反應。由於五氯化磷受熱易離解成三氯化磷和氯,溫度越高,離解度越大,置換能力也隨之而下降;且因氯的存在可能產生芳核上的鹵代或烯鍵加成等副反應,故用五氯化磷進行鹵置換反應時,溫度不宜過高。
(3)鹵代烴的鹵置換反應
鹵代烴分子中的氯或溴原子,與無機鹵化物的氟原子進行交換,這是合成用一般方法難以得到的氟代烴的重要方法。常用的氟化劑有
氟化鉀、
三氟化銻、五氟化銻、氟化汞等,其中以氟化汞的反應性最強。三氟化銻、五氟化銻均能選擇性地作用於同一碳原子上的多鹵原子,而不與單鹵原子發生交換。
CCl3CH2CH2Cl —→CF3CH2CH2Cl
製取氟代烴必須選用耐腐蝕材料做反應器,例如,不鏽鋼、鎳、聚乙烯等。操作中要注意環境的通風,並加強防毒、防腐蝕措施。
鹵化試劑及示例
常用的鹵化試劑有氯氣、溴氣,有時也常用鹽酸加氧化劑(如NaCIO、COCl2)在反應中獲得活性氯。在染料合成中通過已有的—Cl、—Br取代基置換可引入—F取代基。
苯和蒽醌中料的鹵化反應大都是在FeCl
3和MgBr
2催化作用下直接與
氯氣或溴素反應。萘系中料為防止副產物過多一般不常用直接鹵化,萘環上的鹵代基主要通過桑德邁爾(Sandmeyer)或希曼(Schiemann)反應獲得。
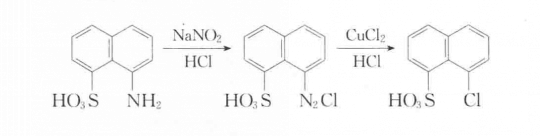 鹵化反應
鹵化反應染料生產中採用較多的氟化方法是經過側鏈氯化,製成三氯甲基的衍生物。再由它來製備相應的三氟甲烷衍生物。
 鹵化反應
鹵化反應 鹵化反應
鹵化反應