基本介紹
- 中文名:脫鹵反應
- 外文名:dehalogenation
- 實質:β-消除
定義
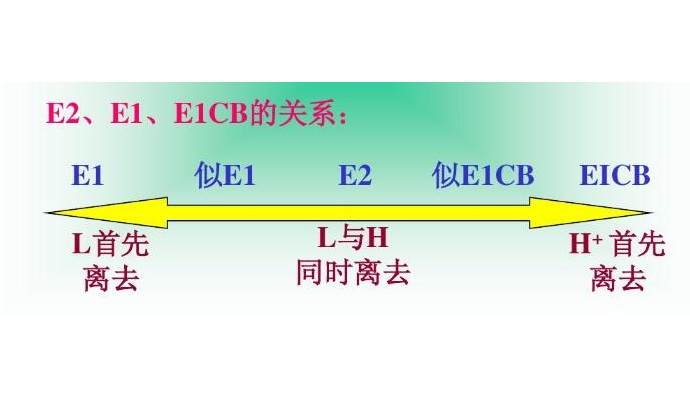
反應機理
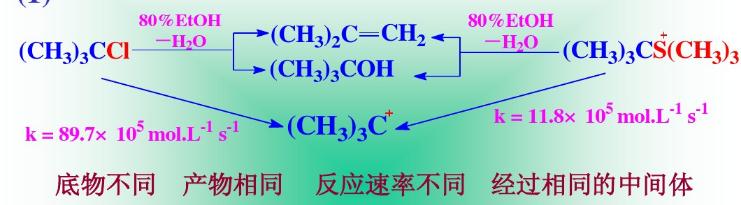
E1消除反應
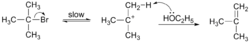
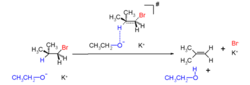
E2消除反應
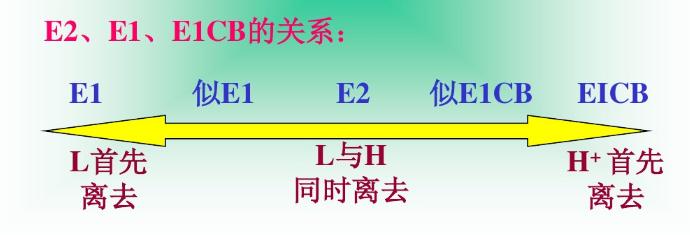
知識擴展




脫鹵反應是有機反應的一種,是將鹵代烷烴和鹼類一起加熱,產生對應烯類的反應。脫鹵反應的實質是β消除。...
脫鹵化氫反應是從有機化合物分了中脫掉鹵化氫的反應。在強鹼作用下,鹵代烷脫去HX生成烯烴。在親核取代反應中同時伴隨著消除反應的發生,取代產物或消除產物那種為...
脫鹵醇反應是指3-鹵醇脫掉次鹵酸生成烯烴的反應、.其中以戶碘醇通過脫碘醇反應生成烯烴的產率最好。...
脫鹵反應(Dehalogenation)是鹵化的逆反應,就是從分子中移除鹵族元素,最常見的是脫鹵化氫反應。 [1] 鹵化有機化合物 編輯 有機化合物鹵化有很多反應途徑,包括...
二、鹵代羧酸的消除反應160 三、其他羧酸的消除反應162 第七章醯滷的消除反應163 第一節醯氯脫鹵化氫生成烯酮163 第二節α-鹵代醯滷的脫鹵反應166 第三節醯...
該反應具體分為三個步驟: 反應介質和 HOPs 在催化劑表面吸附、脫鹵降解反應、降解產物從催化劑表面脫附。[1] 鹵代污染物直接光解機理 ...
然後通過環丙烷化,氧化開環,脫鹵化氫反應,使用Wilkinson催化劑進行催化加氫等反應歷程,最終獲得目標產物。Robinson增環反應由於其獨特的特點,經過幾十年的發展與改進...
2003.04 《亞磺化脫鹵反應及其套用》 黃維垣著 石家莊:河北教育出版社 1999.08 《中國有機氟化學十年進展》 黃維垣等主編 北京:高等教育出版社 1996.11 《中國...
Am. Chem. Soc., 126, 3119 (2004), 水催化異溴仿(CHBr3)脫鹵反應及其產物,Water-Catalyzed Dehalogenation Reactions of Isobromoform and Its Reaction ...
鹵代烴發生消去反應時遵循查依采夫規則。鄰二鹵化合物除可以進行脫鹵化氫的反應外,在鋅粉(或鎳粉)作用下還可發生脫鹵反應生成烯烴。...
