基本介紹
- 中文名:醯胺
- 英文名:acylamide
- 別稱:醯氨
- 外觀:多為無色晶體
- 套用:有機合成中間體
- 結構:平面構型
- 性質:酸鹼性、水解
醯胺的分類
醯胺的命名
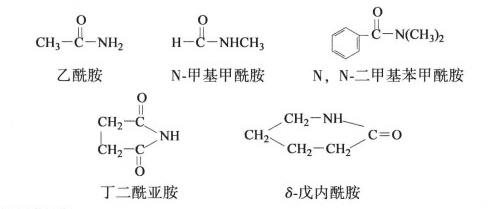 醯胺的命名
醯胺的命名醯胺的結構
物理性質
名稱 | 熔點/℃ | 沸點/℃ | 名稱 | 熔點/℃ | 沸點/℃ |
甲醯胺 | 2.5 | 195 | N,N-二甲基甲醯胺 | —— | 153 |
乙醯胺 | 82 | 221 | 苯甲醯胺 | 130 | 290 |
丙醯胺 | 79 | 213 | 丁二醯亞胺 | 126 | 288 |
己醯胺 | 101 | 255 | 臨苯二甲醯亞胺 | 238 | —— |

 醯胺的命名
醯胺的命名名稱 | 熔點/℃ | 沸點/℃ | 名稱 | 熔點/℃ | 沸點/℃ |
甲醯胺 | 2.5 | 195 | N,N-二甲基甲醯胺 | —— | 153 |
乙醯胺 | 82 | 221 | 苯甲醯胺 | 130 | 290 |
丙醯胺 | 79 | 213 | 丁二醯亞胺 | 126 | 288 |
己醯胺 | 101 | 255 | 臨苯二甲醯亞胺 | 238 | —— |
醯胺是一種化學物質,在構造上,醯胺可看作是羧酸分子中羧基中的羥基被氨基或烴氨基(-NHR或-NR2)取代而成的化合物;也可看作是氨或胺分子中氮原子上的氫被醯基...
醯胺鍵是一種帶負電性的官能團。在有機化學中,醯胺鍵是-CO-NH-,其中碳氧成雙鍵,氮氫成單鍵。肽鍵都是醯胺鍵,醯胺鍵包括肽鍵但不等同於肽鍵。醯胺鍵所指的...
Weinreb醯胺(WAs)是N-甲氧基-N-甲基醯胺。這種醯胺具有與一般醯胺不同的反應特性。它既可與有機鋰試劑或格氏試劑反應高產率地生成酮,也可以被氫化鋁鋰還原生成醛...
煙醯胺(nicotinamide;niacinamide)又稱尼克醯胺,是煙酸的醯胺化合物。為白色的結晶性粉末;無臭或幾乎無臭,味苦;略有引濕性。在水或乙醇中易溶,在甘油中溶解。...
聚丙烯醯胺(PAM )是一種線型高分子聚合物,產品主要分為乾粉和膠體兩種形式。按其平均分子量可分為低分子量(<100 萬)、中分子量(200~400 萬)和高分子量(>700...
又稱十八醯胺。CH3(CH2)16CONH2 白色固體。能與石蠟混溶,溶於有機溶劑,不溶於水。由硬脂酸與氨反應生成銨鹽,再脫水得成品,無吸濕性,滑爽性好,可提高顏料、...
己內醯胺的分子式是C6H11NO,外觀為白色粉末或結晶體,有油性手感。己內醯胺是重要的有機化工原料之一,主要用途是通過聚合生成聚醯胺切片(通常叫尼龍-6切片,或錦綸-...
丙烯醯胺是一種白色晶體化學物質,是生產聚丙烯醯胺的原料。聚丙烯醯胺主要用於水的淨化處理、紙漿的加工及管道的內塗層等。澱粉類食品在高溫(>120℃)烹調下容易產生...
陽離子聚丙烯醯胺(CPAM)是線型高分子化合物,由於它具有多種活潑的基團, 可與許多物質親和、吸附形成氫鍵。主要是絮凝帶負電荷的膠體,具有除濁、脫色、吸附、粘合...
丙醯胺毒性抑制 編輯 雖然人們在高溫焙烤過程中,利用天然產物抑制丙醯胺產生方面有了較為成功的先例,但在體內防護方面還鮮有報導。...
1. 月桂醯胺 .化工空間[引用日期2018-01-18] 2. 月桂醯胺 .chemical book[引用日期2017-05-17] 3. 月桂醯胺 .化學品資料庫[引用日期2017-05-17] 4. 月桂...
甲醯胺是一種化合物,無色透明液體,略有氨味,是合成醫藥、香料、染料等的原料,也可作為溶劑用於合成纖維的抽絲、塑膠加工、木質酪素墨水的生產等。...
環磷醯胺(Cyclophosphamide,CTX)是進入人體內被肝臟或腫瘤記憶體在的過量的磷醯胺酶或磷酸酶水解,變為活化作用型的磷醯胺氮芥而起作用的氮芥類衍生物。抗瘤譜廣,是第...
天門冬醯胺是一種藥物,適用症狀為降血壓, 擴張支氣管(平喘), 抗消化性潰瘍及胃功能障礙。用於微生物培養、丙烯腈的污水處理等。...
神經醯胺是由神經鞘氨醇長鏈鹼基與脂肪酸組成神經鞘氨脂質一種。神經醯胺(Ceramide)是以神經醯胺為骨架的一類磷脂,主要有神經醯胺磷酸膽鹼和神經醯胺磷酸乙醇胺,磷脂...
苯甲醯胺,無色片狀晶體。溶於乙醇和熱水。微溶於乙醚。中性,具有一般醯胺的性質,水解生成苯甲酸和氨。可用苯甲醯氯與氨反應製得。用作有機合成試劑及甘氨酸試劑...
聚醯胺俗稱尼龍(Nylon),英文名稱Polyamide ,它是大分子主鏈重複單元中含有醯胺基團的高聚物的總稱。聚醯胺可由內酸胺開環聚合製得,也可由二元胺與二元酸縮聚等得到...
硬脂酸醯胺產品簡介 中性顆粒狀固體。不溶於水,在常溫下微溶於有機溶劑。能提高染料、顏料的分散效果,親和性。附著性良好,具有潤滑性和脫模性,無吸濕性等優點。...
谷氨醯胺,學名2-氨基-4-氨甲醯基丁酸,英文Glutamine(Gln)。是谷氨酸的醯胺。L-谷氨醯胺是蛋白質合成中的編碼胺基酸,哺乳動物非必需胺基酸,在體內可以由葡萄糖...
二甲基甲醯胺(DMF)是一種透明液體,能和水及大部分有機溶劑互溶。它是化學反應的常用溶劑。純二甲基甲醯胺是有特殊臭味,工業級或變質的二甲基甲醯胺則有魚腥味,...
二醯胺 主要適用症 MRI造影劑,用途同釓噴葡胺 用法用量 靜脈注射,0.lmmol/kg 規格 注射劑:20ml(0.5mol/L) 簡介【藥理作用】 同釓噴葡胺。 【藥代動...
