基本介紹
- 中文名:親核反應
- 外文名:Nucleophilic Reaction
- 套用學科:化學
- 適用領域範圍:化學
- 屬於:有機反應
親核反應定義
親核加成反應
定義
代表反應
判斷標準


親核反應是有機反應的一類,電負性高的或者電子云密度較大的親核基團向反應底物中的帶正電的或者電子云密度較低的部分進攻而使反應發生。與之相對的為親電反應。即...
親核加成反應是由親核試劑與底物發生的加成反應。反應發生在碳氧雙鍵、碳氮叄鍵、碳碳叄鍵等等不飽和的化學鍵上。...
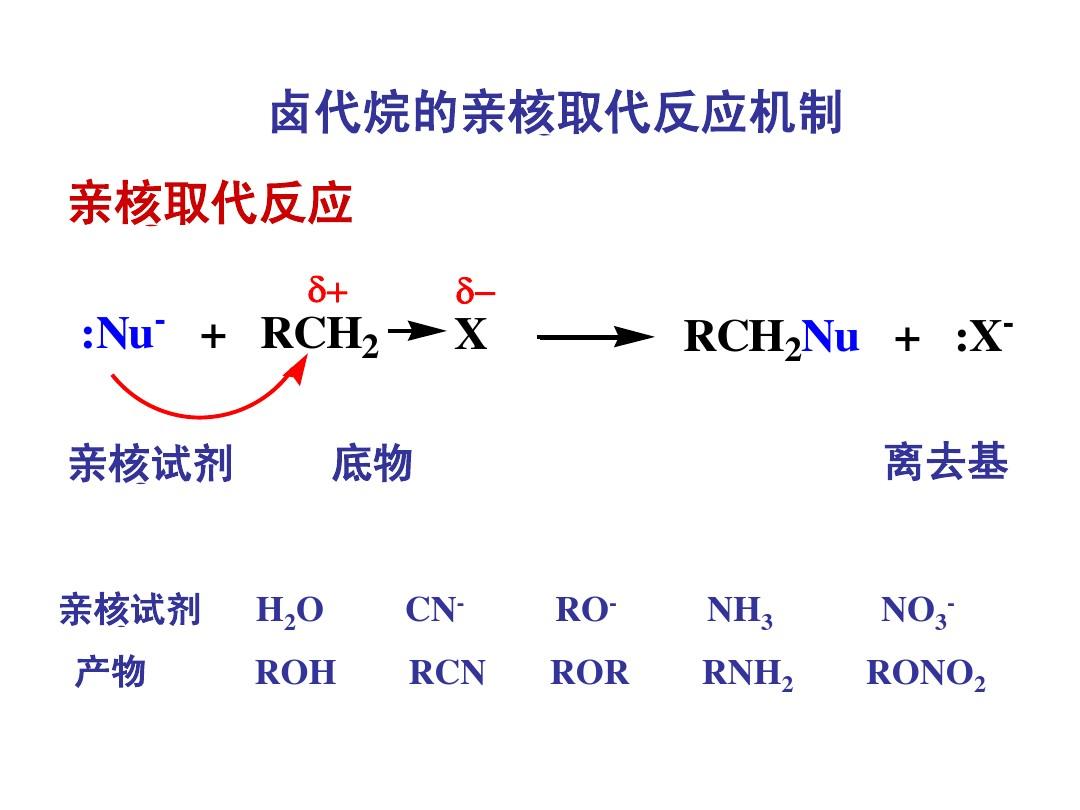
親核取代反應是指有機分子中與碳相連的某原子或基團被作為親核試劑的某原子或基團取代的反應。在反應過程中,取代基團提供形成新鍵的一對電子,而被取代的基團則帶...
親核試劑(nucleophile,意思為原子核的喜好物), 又叫親核基,指具有親核性的化學試劑,可用:Nu表示。一些帶有未共享電子對的分子或負離子,與正電性碳反應時稱為親核...
芳香族親核取代反應(Nucleophilic Aromatic Substitution reaction,SNAr)是親核取代反應的一類,發生在芳香環上。當中一個親核體取代了一個好的離去基團,例如在芳香環上...
親核取代反應簡稱SN。飽和碳上的親核取代反應很多。例如,鹵代烷能分別與氫氧化鈉、醇鈉或酚鈉、硫脲、硫醇鈉、羧酸鹽和氨或胺等發生親核取代反應,生成醇、醚、...
炔烴、含氮化合物生成雜環化合物的反應。由於反應的特性,該反應常常被用於一些功能性物質的合成(醫藥lead compound,生物探針,軟質材料etc)。Sharpless命名該反應為...
分子內親核取代反應(internal nucleophilic substitution)用SNi表示,其中S代表取代,N代表親核,i代表分子內。...
親核體——在反應中能供給電子,並與之共有的物質。它本身帶負電荷或孤電子對。由親核試劑進攻反應物而引起的反應為親核反應。...
有機反應(organic reaction)即涉及有機化合物的化學反應,是有機合成的基礎。幾種基本反應類型為:取代反應、加成反應、消除反應、周環反應、重排反應和氧化還原反應...
雙分子親核取代反應反應(SN2)是親核取代反應的一類,其中S代表取代(Substitution),N代表親核(Nucleophilic),2代表反應的決速步涉及兩種分子。與SN1反應相對應,SN2反應...
炔烴在HgSO4-H2SO4 催化下與水發生親核加成反應最終生成醛或酮的反應,稱為Kucherov 反應。...
親電反應指缺電子(對電子有親和力)的試劑進攻另一化合物電子云密度較高(富電子)區域引起的反應。親電反應屬於離子型反應(ionic reaction)的一種,是有機化學的...
苯炔反應:鹵代芳烴,鄰氨基苯甲酸,過氧化鄰苯二甲酸酐等分別在強鹼,亞硝酸以及光照處理下生成苯炔,苯炔可以與親核試劑發生加成反應。...
取代反應(substitution reaction)是指有機化合物分子中任何一個原子或原子團被試劑中同類型的其它原子或原子團所替代的反應,用通式表示為:R-L(反應基質)+A-B(...
親電取代反應是親電試劑進攻化合物負電部分,取代其它基團的化學反應。一般發生於芳香族化合物,是一種向芳香環系引入官能團的重要方法,是芳香族化合物的特性之一。...
1,2-親核加成大部分的處理方式是增加羰基化合物。因為缺乏極性,所以簡單的烯烴化合物不顯示1,2-親核的反應性,除非用特殊的取代基去激活烯烴。從α,β-不飽和...
Aldol反應(Aldol Reaction)即羥醛縮合/醇醛縮合反應。具有α-H的醛,在鹼催化下生成碳負離子,然後碳負離子作為親核試劑對醛酮進行親核加成,生成β-羥基醛,β-...
