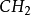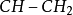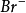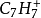發現歷史
碳正離子(Carbenium ion)的歷史可追溯到1891年,G. Merling說他將溴加到
環庚三烯(cycloheptatriene)上,然後加熱結晶化產物取得水溶性物質C
7H
7Br,產生一個他無法解釋的結構.然而, Doering 跟Knox預測是符合Hückel's 規則的溴化環庚三烯的芳香族來解釋這個現象. 1902年,Norris 跟Kehrman分別發現無色的三苯基甲醇在濃硫酸中會變成深黃色.相似地,三苯基氯甲烷會跟
鋁、錫氯化物形成有機複合物.同年,Adolf von Baeyer認為其化合物形成一個類似鹽類的構造.Adolf猜測顏色跟鹽類結構之間的關係就好比孔雀石綠(malachite green). 碳陽離子在許多有機反應中扮演中間物的角色.其概念最早由Julius Stieglitz於1899年發表,Hans Meerwein在他於1922做的研究Wagner-Meerwein rearrangement(重排)(瓦格奈爾-麥爾外因重排)對其概念有更深的發展.且碳正離子在S
N1,E1及重組反應(如Whitmore 1,2 轉移)中被發現有參與反應進行.很長的一段時間,美國的化學家不願意去接受一個新的化學概念,在文章中也不去提到碳正離子此概念.
第一個溶液中穩定的碳正離子的NMR圖譜在1958年時由Doering等人所發表.其為七甲基苯離子(heptamethylbenzenium ion),由六甲基苯加上
氯化鋁、氯甲烷所製成.Story等人於1960製備出穩定的7-norbornadienyl 陽離子,藉由norbornadienyl chloride與-80℃下溶於液態二氧化硫的四氟硼酸銀反應產生.此NMR圖譜顯示出一個非傳統的中間物(第一個發現的非傳統穩定離子) 1962年,Olah藉由核磁共振直接發現三級丁基碳陽離子跟溶於魔酸(magic acid)里的三級丁基氟一樣穩定.Norbornyl陽離子的NMR圖譜最先由 Schleyer等人發表,而Saunders等人則顯示出屏障間質子搶奪的過程.
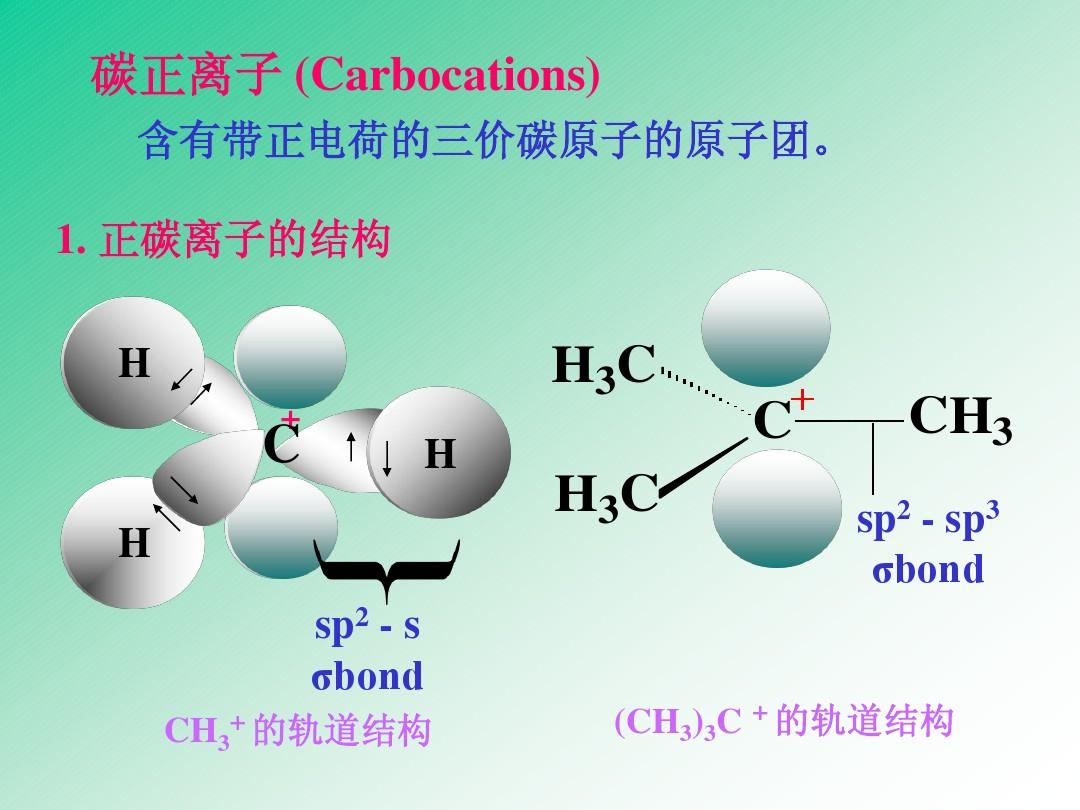
結構
碳正離子與自由基一樣,是一個活潑的中間體。碳正離子有一個
正電荷,最外層有6個電子。帶正電荷的碳
原子以sp
2雜化軌道與3個原子(或
原子團)結合,形成3個
σ鍵,與碳原子處於同一個平面。碳原子剩餘的P軌道與這個平面垂直。碳正離子是平面結構。
1963年有報導,直接觀察到簡單的碳正離子,證明了它的平面結構,為它的存在及其結構提供了實驗依據。
根據帶正電荷的碳原子的位置,可分為一級碳正離子,二級碳正離子和三級碳正離子。
碳正離子的結構與穩定性直接受到與之相連線的基團的影響。它們穩定性的一般規律如下:
(2)其它碳正離子是:3°>2°>1°;
(可以用超共軛解釋不同碳正離子的穩定性)
碳正離子越穩定,能量越低,形成越容易。
碳正離子根據結構特點不同可分為:經典碳正離子和非經典碳正離子
形成過程
碳正離子的形成過程大概是這樣的: C+上原本連有一個
電負性較大的或者吸電子的基團(如-Br, -OH等) 那么這個基團就會將它連線的碳上的電子吸引過去 使該碳稍微顯正電性
吸電子基團在適當溶液中還可能帶著一對電子離去(例如Br- ),那么剩下的
烴基就形成了碳正離子。
反應
穩定性通常用的數量增加的烷基鍵合到電荷軸承碳。叔碳陽離子是更穩定(並形成更容易)比仲碳陽離子,因為它們是由穩定的超共軛。主要碳正離子是非常不穩定的。因此,反應如S
ñ1反應和E1的
消除反應通常不如果將形成伯碳正發生。
然而,雙重鍵合有離子化的碳的碳可以穩定離子通過
共振。這些陽離子作為
烯丙基陽離子,CH
2= CH-CH
2,和
苄基陽離子,C
6ħ
5-CH
2,比大多數其他碳陽離子更穩定。能形成烯丙基或苄carbeniums分子是特別反應性的。碳鎓離子,也可通過穩定的雜原子。
碳正離子可能發生
重排反應,從不太穩定的結構,以同樣穩定或較穩定的人與
速率常數超過10/秒。這一事實複雜的合成途徑許多化合物。例如,當3-戊醇中加熱用HCl水溶液中,最初形成的3-戊基碳正離子重新排列到3-戊基和2-戊基的統計混合物。這些陽離子與氯離子反應,產生約1/3 3-氯戊烷和2/3 -2-氯戊烷。
種類
碳鎓離子被歸類為伯,仲,或叔碳正離子,取決於結合到離子化的碳的碳原子的數目是否為1,2或3。
Alkylium離子
鎓離子
所述
鎓離子是一種芳香族物質與式
。從分子它的名字源於托品(本身命名為分子
阿托品)。所述鎓陽離子的鹽可以是穩定的,如鎓四氟硼酸鹽。它可以從被製成
環庚三烯(tropylidene)和溴或
五氯化磷。它是一個
七邊形的,平面的,環狀的離子;它也有6π電子(4n + 2個,其中,n = 1),這滿足
休克爾規則的芳香。它可以作為一個坐標
配位體,以金屬
原子。
三苯甲基陽離子
三苯基陽離子,(+)C(C
6H
5)3,是特別穩定的,因為該正電荷能夠在10中的碳原子(在3個碳原子的分布鄰和對位這三個苯基基團的位置,再加上中心碳原子)。它存在於化合物中的三苯基甲基六氟磷酸鹽(C(C
6H
5)3PF
6)和高氯酸三苯基(C(C
6H
5)
3ClO
4)。
Arenium離子
一個arenium離子是顯示為在一個反應中間體一環己二烯基陽離子電芳香取代。由於歷史原因,這種複雜的也被稱為韋蘭德中間體,或σ絡合物。兩個氫原子在垂直於苯環鍵合到一個碳位於一個平面內的arenium離子不再是一個芳香物質;然而它是由於離域相對穩定:正電荷經由離域超過5個碳原子的π系統。
Acylium離子
一個acylium離子是與式RCO陽離子。的結構被描述為RC≡O或RC=O。它是合成的和反應性當量的醯基碳陽離子的,但實際的結構具有的氧和碳通過三鍵連線。這些物種是常見的活性中間體,例如,在弗里德爾-克拉夫茨醯化也在許多其他有機反應。
主要作用
碳正離子廣泛存在於許多化學反應中,認識碳正離子有利於把握許多複雜化學反應的本質。分析這種物質對發現能廉價製造幾十種當代必需的化工產品是至關重要的。
歐拉教授發現了利用
超強酸使碳正離子保持穩定的方法,能夠配製高濃度的碳正離子和仔細研究它。他的發現已用於提高煉油的效率、生產無鉛汽油和研製新藥物。