水(H2O),化學性質,水的性質,水也會衰老,水的藥用功能,過氧化氫,分子,理化特性,分解產生氧氣,電解反應,主要用途,超氧化氫,過三氧化氫,製備,過臭氧過程,結構,酸性,反應,存在形式,臭氧酸,
水(H2O) 水包括
天然水 (河流、湖泊、
大氣水 、海水、地下水等),人工制水(通過化學反應使氫氧原子結合得到水)。水(
化學式 :H2O)是由氫、氧兩種元素組成的無機物,在常溫常壓下為無色無味的透明液體。水是地球上最常見的物質之一,是包括人類在內所有生命生存的重要資源,也是生物體最重要的組成部分。水在生命演化中起到了重要的作用。
2.水在1個
大氣壓 (atm,1atmosphere)時(101.325千帕斯卡(kPa)),溫度在0 ℃以下為固體(固態水),0℃為水的冰點。從0℃~100℃之間為液體(通常情況下水呈現液態)。100℃以上為氣體(氣態水),100℃為水的
沸點 。純水在0℃時密度為999.87千克/立方米,在沸點時水的密度為958.38千克/立方米,密度減小4%。在4℃是密度最大,為1000千克/立方米。水的比熱容為4.2*10^3J/(kg·°c)
分子式: H2O分子量:18.02
水 沸點:100℃(一個標準大氣壓下)
化學性質 1.穩定性:在2000℃以上才開始分解。
水的電離:純水中存在下列
電離平衡 :H2O==可逆==H+ +OH- 或H2O+H2O==可逆==H3O+ +OH-
注:"H3O+"為
水合氫離子 ,為了簡便,常常簡寫成H+,純水中氫離子物質的量濃度為10^-7mol/L
2.水的氧化性:水跟較活潑金屬或碳反應時,表現氧化性,氫被還原成氫氣2Na+2H2O=2NaOH+H2↑
Mg+2H2O=Mg(OH)2+H2↑
3Fe+4H2O(水蒸氣)=Fe3O4+4H2↑
C+H2O=CO↑+H2↑(高溫)
3.水的還原性:
最活潑的非金屬氟可將水中負二價氧,氧化成氧氣,水錶現還原性 2F2+2H2O=4HF+O2↑
4.水的電解:
水在電流作用下,分解生成氫氣和氧氣,工業上用此法制純氫和純氧 2H2O=2H2↑+O2↑
5.水化反應:
Na2O+H2O=2NaOH
H2O2 CaO+H2O=Ca(OH)2
SO3+H2O=H2SO4
P2O5+3H2O=2H3PO4
CH2=CH2+H2O←→C2H5OH
氮化物水解:Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑
碳化鈣 水解: CaC2(
電石 )+2H2O=Ca(OH)2+C2H2↑
鹵代烴 水解: C2H5Br+H2O←→C2H5OH+HBr
醇鈉水解:C2H5ONa+H2O→C2H5OH+NaOH
酯類水解:CH3COOC2H5+H2O←→CH3COOH+C2H5OH
多糖水解:(C6H10O5)n+nH2O←→nC6H12O6
7.水分子的直徑
數量級為10的負十次方,一般認為水的直徑為2~3個此單位.。
水的性質 水在常溫常壓下為無色無味的透明液體。在自然界,純水是罕見的,水通常多是酸、鹼、鹽等物質的溶液,習慣上仍然把這種水溶液稱為水。純水可以用鉑或石英器皿經過幾次
蒸餾 取得,當然,這也是相對意義上純水,不可能絕對沒有雜質。水是一種可以在液態、氣態和固態之間轉化的物質。固態的水稱為冰;氣態叫
水蒸汽 。水汽溫度高於374.2℃時,氣態水便不能通過加壓轉化為液態水。
在20℃時,水的熱導率為0.006 J/s·cm·K,凍的熱導率為0.023 J/s·cm·K,在雪的密度為0.1×103 kg/m3時,雪的熱導率為0.00029 J/s·cm·K。水的密度在3.98℃時最大,為1×103kg/m3,溫度高於3.98℃時,水的密度隨溫度升高而減小 ,在4℃時,水的密度最大,在0~3.98℃時,水不服從
熱脹冷縮 的規律,密度隨溫度的升高而增加。水在0℃時,密度為0.99987×103 kg/m3,冰在0℃時,密度為0.9167×103 kg/m3。因此冰可以浮在水面上。
水也會衰老 通常我們只知道動物和植物有衰老的過程,其實水也會衰老,而且衰老的水對人體健康有害。據科研資科表明,水分子是主鏈狀結構,水如果不經常受到撞擊,也就是說水不經常處於運動狀態,而是靜止狀態時,這種鏈狀結構就會不斷擴大、延伸,就變成俗稱的“死水”,這就是衰老了的老化水。現在許多桶裝或瓶裝的純淨水,從出廠到飲用,中間常常要存放相當長一段時間。桶裝或瓶裝的飲用水,被靜止狀態存放超過3天,就會變成衰老了的老化水,就不宜飲用了。
儲存較長時間的水有關未成年人如常飲用存放時間超過3天的桶裝或瓶裝水會使細胞的新陳代謝明顯減慢,影響生長發育,而中老年人常飲用這類變成老化水的桶裝或瓶裝水,就會加速衰老。專家研究提出,近年來,許多地區食道癌及胃癌發病率增多,可能與飲用水有關。研究表明,剛被提取的、處於經常運動、撞擊狀態的深井水,每升僅含亞硝酸鹽0.017毫克。但在室溫下儲存3天,就會上升到0.914毫克,原來不含亞硝酸鹽的水,在室溫下存放一天后,每升水也會產生亞硝酸鹽0.0004毫克,3天后可上升0.11毫克,20天后則高達0.73毫克,而亞硝鹽可轉變為致癌物亞硝胺。有關專家指出:對桶裝水想用則用,不用則長期存放,這種不健康的飲水習慣,對健康無益,喝了一次到兩次對身體沒有害處,時間長有害處。
水的藥用功能 天雨水,性
輕清 ,味甘淡,諸水之上也。夏日尤佳。飲之可以卻病。
水是生命之源。
過氧化氫 分子 分子結構:O原子以sp3雜化軌道成鍵、分子為共價極性分子。
相對分子質量: 34.01
H.O兩種元素的質量比:1×2:16×2=2:32=1:16
外觀與性狀: 水溶液為無色透明液體,有微弱的特殊氣味。純過氧化氫是淡藍色的油狀液體。
理化特性 主要成分: 工業級 分為27.5%、35%兩種。熔點(℃): -0.89℃(無水)
沸點(℃): 152.1℃(無水)
折射率:1.4067(25℃)
相對密度(水=1): 1.46(無水)
飽和蒸氣壓(kPa): 0.13(15.3℃)
結構:H-O-O-H 沒有手性,由於-O-O-中O不是最低氧化態,故不穩定,容易斷開
溶液中含有氫離子,而過氧根在氫離子的作用下會生成
氫氧根 離子,其中氫離子濃度大於氫氧根離子濃度。
毒性LD50(mg/kg):大鼠皮下700
燃爆危險: 本品助燃,具強刺激性。
分解產生氧氣 1.取5ml5%的
過氧化氫溶液 於試管中,將帶火星的木條伸入試管中,木條沒有復燃。
2.取5ml5%的過氧化氫溶液於試管中,加熱,再將帶火星的木條伸入試管中,木條復燃。
3.取5ml5%的過氧化氫溶液於試管中,加入少量
二氧化錳 ,再將帶火星的木條伸入試管中,木條復燃。二氧化錳做催化劑,和過氧化氫反應生成氧氣和水。
(一)、過氧化氫 1、 過氧化氫的分子結構 過氧化氫是含有極性鍵和非極性鍵的極性分子,其結構式為H—O—O—H,電子式為: 2、 過氧化氫的物理性質 過氧化氫是一種無色黏稠的液體,它的水溶液俗稱雙氧水。 3、 過氧化氫的化學性質
(1)H2O2是二元弱酸,具有酸性
(2)氧化性
H2O2+2KI+2HCl=2KCl+I2+2H2O
2Fe2++H2O2+2H+=2Fe3++2H2O
H2O2+H2S=S↓+2H2O H2O2+SO2=H2SO4
註:在酸性條件下H2O2的還原產物為H2O,在中性或鹼性條件其還原產物為氫氧化物.
(3)還原性
2KMnO4+5H2O2+3H2SO4=2MnSO4+K2SO4+5O2↑+8H2O
H2O2+Cl2=2HCl+O2 註:H2O2的氧化產物為O2
(4)不穩定性 4、 H2O2的保存方法 實驗室里常把H2O2裝在棕色瓶內避光並放在陰涼處。 5、 H2O2的用途 作消毒、殺菌劑,作漂白劑、脫氯劑,純H2O2還可作火箭燃燒的氧化劑等。
電解反應 電解雙氧水會生成臭氧和水,同時水又生成氫氣和氧氣。
一、3H2O2=(通電)=3H2O+O3↑
二、2H2O=(通電)=2H2↑+O2↑
總反應化學方程式為:
6H2O2=(通電)=6H2↑+2O3↑+3O2↑
首次生成的臭氧顏色為橙黃。
主要用途 醫用雙氧水(3%左右或更低)是很好的消毒劑 。
工業用是10%左右用於漂白,作強氧化劑,脫氯劑,燃料等。
實驗用做制O2原料。
超氧化氫 化學式:HO2
由臭氧和水反應而得。
H2O + O3 ==== 2HO2
近來義大利科學家發現O4後,又有一新的製取方法:
H2 + O4 ==== 2HO2(條件只需微熱)
反應在冷凝管中進行,可穩定保存在棕色細口瓶中。
藍色液體,氧化性很強,又擬鹵素氫化物的性質:
HO2 + AgNO3 ==== AgO2↓(微溶) + HNO3
8HO2 + 2MnO2 ==== 2HMnO4 + 3H2↑ +6O2↑
電解:2HO2 ==== H2↑ + O4↑
將活潑金屬投入其中會燃燒起來,同時在表面分解產生的氫氣也會燃燒,有時甚至會發生爆炸。因此超氧化氫又被稱為“火氫水”。
據說0.5%~2%的火氫水防毒效果不亞於雙氧水,因此火氫水可能成為一種新的消毒劑使用。
另外,反應8HO2 + 2MnO2 ==== 2HMnO4 + 3H2↑ +6O2↑ 可用於制氧氣(利用向上排空氣法可除去氫氣)。
一般以雙分子形式存在,十分不穩定,加熱會爆炸。
一種弱酸,也是一種自由基,具有極高的活性。超氧化物(超氧化鉀/銣/銫/鈣/鍶/鋇)於冷水或稀酸反應可生成,常溫存在時間極短,很快分解成水和氧氣。4HO2=2H2O+3O2↑。因而是很強的氧化劑.
超氧酸分子中含有未成對電子,因此具有順磁性,中心氧原子為sp3雜化,不能形成π鍵,是和左右的原子分別形成兩個σ鍵
HO2 過三氧化氫 上述反應的
逆反應 (向水分子中插入單線態氧原子)一般情況下由於單線態氧原子不足而速率小於正反應速率。
理論研究表明,過三氧化氫有順式和反式共兩種
異構體 ,其中反式異構體比順式異構體更穩定。二階全活化空間微擾理論(complete active space perturbation theory of second order,CASPT2)預測結果顯示,在單激發態中,順式過三氧化氫壽命最長的激發態為21A",
躍遷能 為167.43
nm ,壽命為1.44×10
s ;而反式過三氧化氫壽命最長的激發態為21A,其躍遷能為165.52nm,壽命為2.07×10s。
在
生命系統 中,
臭氧 是由單線態氧形成的,現在推測其原理是:臭氧是單線態氧與水產生的H2O3的抗體
催化 產物 。
製備 過三氧化氫可由
O3 和
H2O2 的反應或水的電解少量製備。用以上兩種反應製得的過H2O3的量雖然較少,但已可檢測出其存在。
若需獲得大量H2O3,則要利用有機還原劑(例如
氫化偶氮苯 )在
有機溶劑 中低溫
還原 O3,H2O3也能在有機過三氧化氫分解時產生(ROOOH)。
過臭氧過程 O3與H2O2反應(過臭氧化)的過程也被稱為“過臭氧過程”(Peroxone process)。而O3與H2O2的
混合物 曾被用作含有各種
有機化合物 的
地下水 的處理劑。上述反應也能產生H2O5及一些
環狀化合物 。
結構 光譜學 分析已指出H2O3
分子 具有曲折的結構(H-O-O-O-H),具有C2對稱性,其中,H2O3O-O鍵的
鍵長 約為142.8
pm ,略短於H2O3中的146.4pm。O-H鍵的鍵長為96.6pm,H-O-O鍵角為101.9°,O-O-O鍵角為106.8°,H-O-O-O二面角為81.2°。
酸性 反應 其能自發地分解為水與單線態氧。室溫下有機溶劑中的H2O3的
半衰期 約為16
min ,而H2O3在水中的半衰期只有幾
毫秒 。
H2O3能與有機硫化物反應生成
亞碸 ,但現在對這類反應的了解仍不多。
存在形式 2005年 ,H2O3被利用微波光譜學在超音速客機中發現,其分子呈現反式
構象 (trans conformation),其中的O-O鍵短於H2O2中的O-O鍵。
計算化學 方面的預測表明還可能有包含更多
氧 原子 的鏈狀分子(或多氧化氫)存在,在低溫
氣體 中,甚至連具有無數個氧原子的鏈也可能存在。
在該證據支持下,一項對
星際物質 中的這類物質的尋找可能將會展開。
臭氧酸 一種弱酸,也是一種自由基,具有極高的活性.
臭氧化物 (臭氧化鈉/鉀/銣/銫/鈣/鍶/鋇)於冷水或稀酸反應可生成,常溫存在時間極短,很快分解成水和氧氣.4HO3=2H2O+5O2↑因而是很強的氧化劑.
臭氧酸分子中含有未成對電子,因此具有順磁性.中心氧原子為sp2雜化,用一個電子與端邊氫原子形成σ鍵,用兩個電子與端邊氧原子成單電子形成三電子π鍵.
 水
水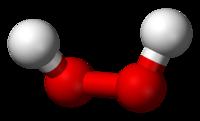 H2O2
H2O2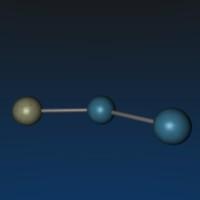 HO2
HO2
 水
水 H2O2
H2O2 HO2
HO2