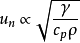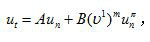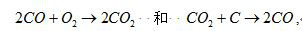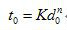簡介
可燃物與氧氣或空氣進行的快速放熱和發光的氧化反應,並以火焰的形式出現。 煤、石油、天然氣的燃燒是國民經濟各個部門的主要熱能 動力的來源。近世對能源需求的激增和航天技術的迅速 發展,促進了流體力學,化學反應動力學、傳熱傳質學的 結合,使燃燒學科有了飛躍的發展;另一方面以消滅燃燒 為目的的防火技術的發展也促進了燃燒理論的研究。
在燃燒過程中,燃料、氧氣和燃燒產物三者之間進行 著動量、熱量和質量傳遞,形成火焰這種有多組分濃度梯 度和不等溫兩相流動的複雜結構。火焰內部的這些傳遞 借層流分子轉移或湍流微團轉移來實現,工業燃燒裝置 屮則以湍流微團轉移為主。探索燃燒室內的速度、濃度、 溫度分布的規律以及它們之間的相互影響是從流體力學 角度研究燃燒過程的重要內容。由於燃燒過程的複雜性, 實驗技術是探討燃燒工程的主要手段。近年來發展起來 的計算燃燒學,通過建立燃燒過程的物理模型對動量、能 量、化學反應等微分方程組進行數值求解,從而使對燃燒設備內的流場、燃料的著火和燃燒傳熱過程、火焰的穩定 等工程問題的研充取得明顯的進展。
著火
即可燃物開始燃燒。可燃物必須有一定的起始能量,達到一定的溫度和濃度,才能產生足夠快的反應速度而著火。大多數均相可燃氣體的燃燒是鏈式反應,活性屮間物的濃度 在其中起主要作用。如果鏈產生速度 起過鏈中止速度,則活性中間物濃度將不斷增加,經過一段時間的積累(誘導期)就自動著火或爆炸。著火溫度除與可燃混合物的特性有關外,還與周圍環境的溫度、壓力,反應容器的形狀、尺寸等向外散熱的條件有關。當氧化釋放的熱量超過系統散失的熱量時,燃料就會快速升溫而著火。這種同流動和傳熱有密切聯繫的著火稱為熱力著火,它是多數燃料在燃燒設備內所經歷的著火過程。在燃料的活性較強、燃燒系統內壓力較高和散熱較少的情況下,燃料的熱力著火溫度會變得低一些。在一定壓力下,可燃物有著火濃度的低限和高限,在這個範圍以外,不管溫度多高都不能著火。在大氣壓力下,某些可燃氣體在空氣中的著火性質如附表所示。
工程中使用得較為普遍的著火方法是強迫著火,它是用外部能源或熾熱物體如電火花、引燃火炬、高溫煙氣回流等點燃冷的可燃物。在點燃部位首先出現火焰,然後通過湍流混合和傳熱,火焰鋒面逐漸擴展到整個可燃物。 強迫著火是由點火源向周圍可燃氣體加熱,因此點燃溫度要高於可燃物的自燃溫度。
火焰
激烈進行發光、放熱反應的界面或空間稱為火焰,其亮度取決於可燃物的性質。熾熱的煙氣發光較弱,形成白色火焰。如果燃燒區內有固體微粒(如碳黑),就會出現發光強烈的火焰。
名稱 | 著火溫度(℃) | 著火濃度範圍(%) |
低限 | 高限 |
氫 | 530~590 | 4.0 | 75.0 |
一氧化碳 | 610~658 | 4.3 | 12.5 |
甲烷 | 645~850 | 5.3 | 15.0 |
乙烷 | 530~594 | 3.0 | 12.5 |
乙烯 | 490~550 | 3.1 | 32.0 |
乙炔 | 335~500 | 2.5 | 80.0 |
硫化氫 | 290~487 | 4.3 | 45.0 |
氨 | 651 | 15.5 | 26.6 |
發生爐煤氣 | 530 | 20.7 | 73.7 |
火焰鋒面在可燃混合物中的傳播形成燃燒波。燃燒 波的傳播有兩種方式:一種為正常燃燒,是通過熱量傳遞使未燃氣體溫度升高而引起燃燒,或由於活性中間物質擴散到未燃氣體中引起反應而燃燒。正常燃燒典型的火 焰速度約50厘米/秒,常壓下火焰厚度為數毫米,燃燒在燃燒波內完成。通常的燃燒設備和噴氣發動機內的燃燒即屬此類。另一類為爆震(又稱爆轟),是靠極薄的激波 傳播的,波面兩側壓力和溫度可相差十倍,甚至更多,使可燃物在激波後的燃燒區迅速完成反應。爆震的傳播速 度可達每秒2〜5千米(氣體爆炸物)或8〜9千米(固體和液體爆炸物),因而具有很強的破壞力。在正常燃燒中通常遇到的火焰有:
預混火焰 可燃氣體和空氣或氧氣按化學當量比預先混合後燃燒時所形成的火焰,又稱動力燃燒火焰。化學反應局限在很窄的火焰鋒面內,以一定的速度向可燃氣體傳播。火焰鋒面位移的法向速度稱為正常火焰傳播速 度υn(厘米/秒),可表示為:
式中
、c
p和ρ分別為可燃物的熱導率、定壓比熱和密 度。可見,
是僅與可燃物特性有關的常數,其數值通 常在毎秒幾厘米至幾米的範圍內。工業上的無焰燃燒就 是可燃混合物在容積不大的耐火材料製成的隧道中的燃 燒,具有火焰短、燃燒強度大和高溫區集中等特點。
層流火焰 靜止或處於層流運動的可燃混合物燃燒 時形成的火焰。它以正常速度擴展,火焰鋒面光滑而明顯,可燃氣體在鋒面各點的法向分速均等於正常火焰傳播速度(見圖)。
層流火焰和湍流火焰 左邊為長時間曝光照片 右邊為紋影照片 上部為層流火焰 下部為湍流火焰
湍流火焰 可燃混合物達到湍流工況後燃燒時所形成的火焰。工業上套用的大都是使可燃混合物從噴嘴流出的速度達到湍流工況後燃燒所形成的火焰。由於氣流的脈動,湍流火焰鋒面厚度比層流火焰大得多(見圖,下 左為長時間曝光照片)。當氣流脈動速度不大且脈動微團的平均尺寸小於層流火焰鋒面厚度(通常為0.01 〜1.0毫米)時,稱為小尺度湍流火焰(雷諾數為2300~6 000) ;這時火焰鋒面呈波紋狀(見圖,下右紋影照片),用湍流的物性參量代人層流火焰擴展的理論公式即可求解。當氣流脈動速度不太大,但脈動微團的平均尺寸大於層流火焰鋒面厚度時,稱為大尺度端流火焰(雷諾數≥6000);此時火牆鋒面彎曲得很利害,使反應表面積大增。根據湍流火焰傳播的理論,燃燒速度和火焰的鋒面面積成比例,故湍流燃燒速度比層流燃燒速度大得多。如果雷諾數更高,氣流脈動和湍流微團尺寸都很大,火焰鋒面就被撕得四分五裂,不再以連續面出現。部分被撕裂的可燃物火焰鋒面和高溫煙氣合併到新形成的微團內,使微團內也出現燃燒,這是湍流容積燃燒理論的構想。此時燃燒速度和氣流脈動速度成比例。但實驗發現湍流燃燒速度往往要比氣流脈動速度大好幾倍,這是因為在火焰鋒面中溫度劇增,氣流膨脹和可燃物濃度降低導致火焰鋒面內產生很大的速度、溫度和濃度梯度,從而使脈動速度顯著增加,使燃燒速度也相應增加。不過總的說來,湍流燃燒理論還不夠成熟。湍流燃燒速度ut (米/秒)主要通過實驗來確定,通常可表為;
式中為氣流脈動速度;A、B、m、n為實驗常數,對常見的可燃氣體,A→0,B=2.5~5. 3,m=1. 0~0. 8,n=0~0.2。
擴散火餡 未經預先混合的可燃物和氧氣(或空氣)燃燒時形成的火焰。這種火焰鋒面把可燃物和氧氣分隔開,兩者均需依靠濃度梯度向火焰鋒面進行分子擴散和湍流擴散(見擴散),因此火焰的形狀和燃燒的速度主要取決於可燃物和氧的熱量、質量交換和混合的速度,而不是化學反應速度。擴散火焰可分為均相和非均相兩類;前者如氣體燃料的擴散燃燒形成的火焰,後者如固體或液體燃料的燃燒形成的火焰。固體燃料燃燒時,往往要經歷預熱、乾燥、揮發成分的析出和著火、焦炭的著火和燃燒等階段。這些階段互有重疊,其中以焦炭燃燒所需時間為最長。溫度較低時,對燃燒速度起決定作用的是化學反應速度;當溫度足夠高、化學反應速度已很快時,燃燒速度便取決於氧向固體燃料表面的擴散速度和燃燒產物的離去速度。焦炭燃燒時的生成物CO和CO2在擴散離去時還可能產生二次反應。
故只有溫度較低時,氧才有可能擴散到焦炭表而,而在溫度較高時,氧在擴散途中就與CO反應而被消耗殆盡。同時高濃度的CO2反而向焦炭表面擴散,進行二次反應。液體燃料的燃燒也靠擴散,但對於輕質燃料,液滴表面只有蒸發而無反應,因為它的沸騰溫度低於著火溫度。對於重質燃料,沸程寬,在液滴內便進行裂解,產生的可燃氣體在向外擴散過程中進行燃燒。直徑為如d0(厘米)的煤粒或油滴燃燒所需時間t0(秒)可用下述經驗公式表達:
式中K為由燃料特性、流動工況、爐溫所決定的經驗常數(秒/厘米);n為常數。理論值n=2;實驗值n=1.5~2.0。
火焰的穩定 為使燃燒持續,火焰鋒面需穩定在某一位置上,其必要條件是可燃物向鋒面流動的速度等於火焰鋒面向可燃物擴展的速度。可燃物流速如果高於後者,火焰即被吹脫,此時的速度稱為吹脫速度。由於工業燃燒裝置中可燃物的流速大大高於火焰擴展速度,因此大多採用一些流體力學的手段來穩定火焰。常用的方法有:使用引燃火炬,不斷對高速可燃氣流進行點燃;設計非流線型物體作為穩燃器或使用產生高速旋轉射流的燃燒器,使其後部出現低速的回流區並吸引高溫燃燒產物回流以穩定火焰。