將光化學與電化學方法合併使用,以研究分子或離子的基態或激發態的氧化還原反應現象、規律及套用的化學分支。屬於化學與電學的交叉學科。
基本介紹
- 中文名:光電化學
- 外文名:photoelectrochemistry
- 別稱:研究光直接影響電極過程的電化學
簡介
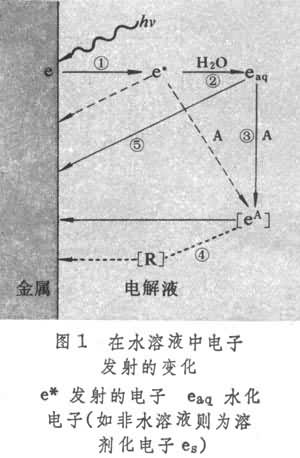 光電化學
光電化學簡史
 光電化學
光電化學光電化學
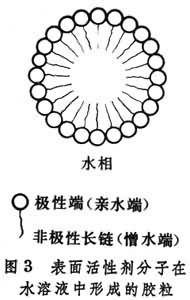 光電化學
光電化學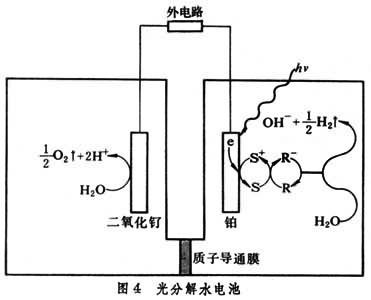 光電化學
光電化學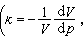 光電化學
光電化學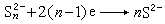 光電化學
光電化學 光
光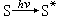 光電化學
光電化學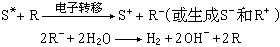 光電化學
光電化學
將光化學與電化學方法合併使用,以研究分子或離子的基態或激發態的氧化還原反應現象、規律及套用的化學分支。屬於化學與電學的交叉學科。
 光電化學
光電化學 光電化學
光電化學 光電化學
光電化學 光電化學
光電化學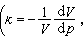 光電化學
光電化學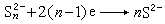 光電化學
光電化學 光
光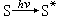 光電化學
光電化學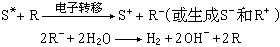 光電化學
光電化學將光化學與電化學方法合併使用,以研究分子或離子的基態或激發態的氧化還原反應現象、規律及套用的化學分支。屬於化學與電學的交叉學科。...
光電化學電池是指利用半導體一液體結製成的電池。光電化學電池一般分為電化學光伏電池、光電解電池和光催化電池三類。...
1971年Fujishima和Honda用二氧化鈦電極光助電解水獲得了氫氣,開始了具有實際意義的光電化學制氫的研究。光電化學中光電轉換效率是一個非常重要的指標,而評價光電化學...
光電化學刻蝕在光照射下,半導體基質在與其相接觸的電解質溶液中的溶蝕過程,這種技術用於半導體表面的光學製版工藝。...
光電催化指的是通過選擇半導體光電極(或粉末)材料和(或)改變電極的表面狀態(表面處理或表面修飾催化劑)來加速光電化學反應的作用。...
《光電催化化學》是2005年科學出版社出版的圖書,作者是劉尚長。本書共分十章,主要包括緒論,理論基礎,光電催化反應和催化劑,量子光電催化動力學,有機、無機、...
江漢大學光電化學材料與器件教育部重點實驗室於2011年10月獲批組建,並於2015年10月順利通過教育部驗收。實驗室以江漢大學為依託,面向國家重大需求,以化學與材料科學...
藻膽蛋白單分子膜的光物理和光電化學行為是何靳安所著的論文...... 藻膽蛋白單分子膜的光物理和光電化學行為是何靳安所著的論文 副題名外文題名...
中國科學院光電材料化學與物理院重點實驗室依託中國科學院福建物質結構研究所。實驗室是在福建物質結構研究所材料化學與物理室的基礎上通過不斷創新實踐發展建立的,...
半導體電化學是研究半導體在電解質溶液中的電化學行為。電化學研究電子導體的電極體系,而半導體電化學則研究半導體即電子和空穴兩種載流子的電極體系以及在此體系中電能...
楊術明:男,1963年01月生,博士,信陽師範學院化學化工學院教授,校特聘教授,碩士生導師,河南省教育廳學術技術帶頭人,信陽師範學院套用化學研究所副所長,國家自然科學...
到目前為止,對太陽能制氫的研究主要集中在如下幾種技術:熱化學法制氫、光電化學分解法制氫、光催化法制氫、人工光合作用制氫和生物制氫。...
