基本介紹
介紹
詳解
 雙電層
雙電層
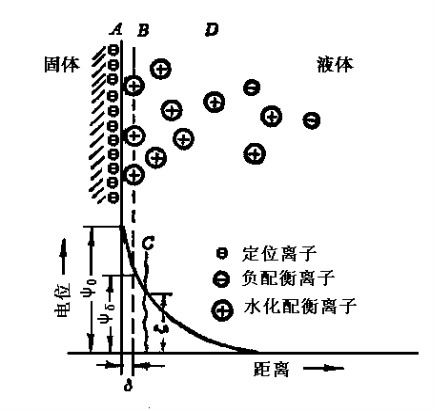
 雙電層
雙電層
任何兩個不同的物相接觸都會在兩相間產生電勢,這是因電荷分離引起的。兩相各有過剩的電荷,電量相等,正負號相反,相互吸引,形成雙電層。...
雙電層理論是微粒的內部稱為微粒核 一般帶負電荷形成一個負離子層(即決定電位離子層),其外部由於電性吸引 而形成一個正離子層(反離子層 包括非活動性離子層和...
雙電層電容器(Electrical Doube-Layer Capacitor)是超級電容器的一種,是一種新型儲能裝置。雙電層電容器介於電池和電容之間,其極大的容量完全可以作為電池使用。雙...
擴散雙電層是指當帶電的膠體顆粒分散在電解質溶液中時,由於靜電吸引,溶液中帶異號電荷的離子(反荷離子)向表面靠近,同時離子的熱運動又使其向遠離表面的方向擴散...
雙電層力(英語:double layer forces)是表征雙電層相互作用的物理量。...... 雙電層力(英語:double layer forces)是表征雙電層相互作用的物理量。...
斯特恩雙電層是指帶電固體表面周圍的反離子有一些因為靜電吸引和范德華吸引的雙重作用而與固體表面緊密結合,它們與結合在固體表面上的溶劑分子一起構成所謂的Stern層...
處,正負電荷兩者所構成的淨電位為零,這個區域稱為擴散層;此二層稱為Gouy-Chapman雙電層或diffuse electric double layer(中譯為擴散電雙層、電雙層或擴散雙電層)...
雙電層形變(deformation of double layer)是離子導體激發極化效應的假說之一。在外電場作用下,岩石顆粒表面散漫層的對稱性受到破壞,離子發生位移,稱為雙電層形變...
土壤膠體的帶電顆粒分散在電解質溶液中時,由於靜電引力,在膠粒周圍形成一帶反號電荷的離子層,這樣膠粒表面的電荷層與周圍的反離子層就形成了雙電層結構。雙電層...
電荷雙層是指如果電子或離子等荷電粒子在兩相中具有不同的電化學位,荷電粒子就會在兩相之間發生轉移或交換,界面兩側便形成符號相反的兩層電荷。...
雙電層電容器(ElectricalDouble-LayerCapacitor)又叫超級電容器,是一種新型儲能裝置,它具有充電時間短、使用壽命長、溫度特性好、節約能源和綠色環保等特點。雙電層...
亥姆霍茲雙電層Helmhalt}'s }iouhle laye:由Helmhaltt 最早提出的一種雙電層結構。他認為雙電層的結構與平行板 電容器相似,雙電層的裡層在固體表面上,相反...
緊密(雙f層、npact (douhie) lave:電極界面雙電層模型的電解液一側,電荷緊靠電極金屬的部分,或稱亥姆霍茲雙層(Helmholtz douh:e layer]。這是因離子和分子〔...
簡介 電極的雙電層微觀模型‘}.電解質一側電荷分布的分散部分。 ...... 電極的雙電層微觀模型‘}.電解質一側電荷分布的分散部分。[1] 參考資料 1. 化學化工大...
根據Stern雙電層理論可將雙電層分為兩部分,即Stern層和擴散層。Stern層定義為吸附在電極表面的一層離子(IHP or OHP)電荷中心組成的一個平面層,此平面層相對遠離...
